
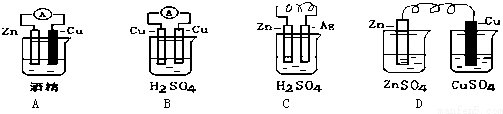
分析 原电池能够实现化学能转化为电能,根据构成原电池的条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应分析,负极发生氧化反应,正极发生还原反应,由此分析解答.
解答 解:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,
A.无水乙醇为非电解质,该装置不能自发的进行氧化还原反应,所以不能形成原电池,故A错误;
B.该装置中电极材料相同,所以不能形成原电池,故B错误;
C.该装置符合构成原电池的条件,故C正确;
D.该装置不能构成闭合回路,所以不能形成原电池,故D错误;
C装置中Ag作正极,正极上氢离子得电子生成氢气,其电极反应为:2H++2e-=H2↑,负极为锌失电子生成锌离子,反应式为Zn-2e-=Zn2+;总反应为:2H++Zn=Zn2++H2↑;阴离子移向负极锌;装置中转移了0.2mol电子,根据总反应为:2H++Zn=Zn2++H2↑,则理论上整体质量增重0.1×65-0.1×2=6.3g.
故答案为:C;2H++2e-=H2↑;Zn-2e-=Zn2+;Zn;6.3g.
点评 本题考查了原电池原理的应用、化学方程式的书写等,为高频考点,注意把握原电池的正负极的判断及电极反应方程式的书写方法是解决本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
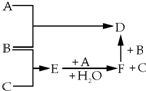 有A、B、C三种常见单质,其有关反应如图所示:已知B、E的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化,B显黄绿色,D遇KSCN溶液显血 红色.
有A、B、C三种常见单质,其有关反应如图所示:已知B、E的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化,B显黄绿色,D遇KSCN溶液显血 红色. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
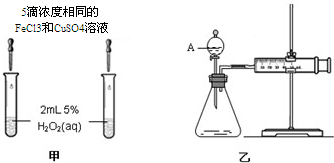
| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未明显见到有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①②③ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S分子呈V形 | |
| B. | H2S沸点低于H2O沸点,因为S-H键键能低 | |
| C. | H2S分子中只含σ键 | |
| D. | H2S分子稳定性低于H2O分子,因为O-H键键能高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com