
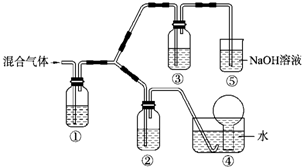
 (一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10ˉ6 | 6x 10ˉ6 | 2x10ˉ5 | 4x10ˉ5 | 3x10ˉ5 | 2x10ˉ5 |
| 3 |
| 4 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 4 |


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
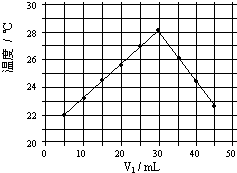 (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
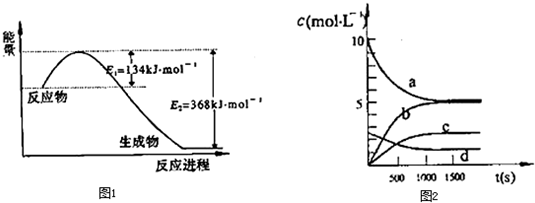
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
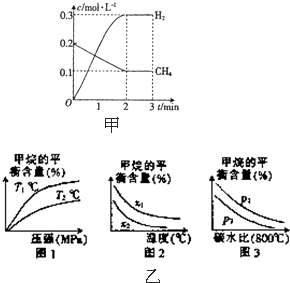 工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.
工业上利用天然气(主要成分是CH4)与H2O进行重整制备合成气(CO+H2),CO和H2在一定条件下能制备甲醛、甲醚和葡萄糖等多种有机物.| t/min | n(CH4)/mol | n(H20)/mol | n(CO)/mol | n(H2)/mol |
| 4 | 0.18 | 0.38 | 0.22 | 0.66 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
| C-O | C=O | C≡O | |
| CO | 357.7 | 798.9 | 1071. 9 |
| N-N | N=N | N≡N | |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com