
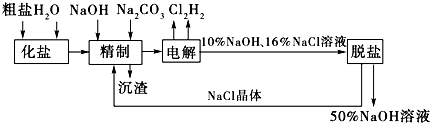
分析 (1)工业食盐中含有较多的Ca2+、Mg2+杂质,可以用试剂NaOH、Na2CO3除去,所以离子反应式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓,如果含有SO42-,则可加Ba2+形成BaSO4白色沉淀;由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2;为了有效除去Mg2+、Ca2+和SO42-,必须先加钡试剂或NaOH,最后加入Na2CO3溶液,如果先加入Na2CO3溶液,后加BaCl2或Ba(OH)2,则多余Ba2+无法除去;
(2)电解NaCl溶液时,在与电源正极相连的电极上(阳极),Cl-失去电子生成Cl2:2Cl--2e-=Cl2;在与电源负极相连的电极(阴极)发生的反应为:2H++2e-=H2,消耗H+,产生OH-,所以附近的pH上升;检验氯气通常使用湿润的碘化钾淀粉溶液;
(3)经过一段时间的电解,NaCl溶液浓度在下降,NaOH溶液浓度在上升.当NaOH溶液质量分数变成10%,NaCl溶液质量分数变成16%时,停止电解,电解液加热蒸发,由于NaOH的溶解度大于NaCl,通过蒸发浓缩、冷却、结晶和过滤后可除去后经过滤除去NaCl,获得的NaCl可循环使用,据此进行解答.
解答 解:(1)除去粗盐中的SO42-,可加Ba2+形成BaSO4白色沉淀,由于不能引进其他阴离子,所以钡试剂只能用BaCl2或Ba(OH)2,故ac正确,
故答案为:ac;
(2)在电解过程中,与电源负极相连的电极为阴极,电解池中阴极氢离子得到电子生成氢气,电极反应式为:2H++2e-═H2↑;阳极氯离子失去电子生成氯气,氯气能够使淀粉碘化钾溶液变蓝,可用淀粉碘化钾溶液检验氯气,
故答案为:2H++2e-═H2↑;淀粉KI溶液;
(3)氢氧化钠的溶解度随温度的升高而增大,但是氯化钠的溶解度受温度的影响不大,则在温度高的时候,生成氢氧化钠晶体即可除去氯化钠,所以氢氧化钠和氯化钠分离的方法是:蒸发浓缩、冷却、结晶、过滤;
故答案为:浓缩;过滤.
点评 本题考查氯碱工业,题目难度中等,涉及电解原理、粗盐提纯、化学实验基本操作方法的应用等知识,明确发生的离子反应及电解反应原理是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序.


科目:高中化学 来源: 题型:解答题
| 物质 | 组成和结构信息 |
| a | 仅由A和E两元素组成的离子化合物 |
| b | 由D和E组成的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 化学组成为A2GD4 |
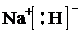 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 不慎将油汤洒在衣服上可用酒精、汽油等除去,它们能将油污从汤液中萃取出来而除去 | |
| D. | 玻璃是用石灰石,纯碱和二氧化硅等原料熔炼而成,在熔炼过程中发生了化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测氯水的pH | |
| B. | 用磨口玻璃瓶保存NaOH溶液 | |
| C. | 中和滴定时锥形瓶使用前需用待测液润洗 | |
| D. | 用CS2可除去试管内壁残留的S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37Cl中的37代表该原子的相对原子质量 | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 丙烷分子的比例模型: | |
| D. | 第三周期简单阴离子结构示意图均可表示为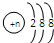 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通入过量的CO2气体:CO2+2OH-═HCO3-+H2O | |
| B. | 过量氢氧化钙与碳酸氢镁溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| C. | Fe3O4与稀硝酸反应:Fe2O3+8H+═Fe2++Fe3++4H2O | |
| D. | 偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+═Al3++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com