
【题目】实验室利用如图装置制取有机物,下列说法错误的是( )

A.根据温度计读数的不同,可制取乙烯和乙醚
B.b为恒压滴液漏斗,其优点是便于液体顺利滴下
C.将产生的气体通入酸性高锰酸钾溶液,若溶液褪色,则证明有乙烯生成
D.浓硫酸在反应中的作用可能有:催化、吸水、氧化、脱水
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】常用调味剂花椒油是一种从花椒籽中提取的挥发性香精油,可溶于乙醇、乙醚等有机溶剂。利用如图所示装置处理花椒籽粉,经分离提纯得到花椒油。
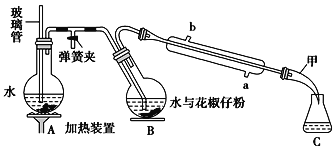
实验步骤:
(一)在A装置中的圆底烧瓶中装入![]() 容积的水,加几粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
容积的水,加几粒沸石。同时,在B中的圆底烧瓶中加入20g花椒籽粉和50mL水。
(二)加热A装置中的圆底烧瓶,当有大量蒸气产生时关闭弹簧夹,进行蒸馏。
(三)向馏出液中加入食盐至饱和,再用15mL乙醚萃取2次,将两次萃取的醚层合并,加入少量无水Na2SO4;将液体倾倒入蒸馏烧瓶中,蒸馏得花椒油。
(1)装置A中玻璃管的作用是___,装置B中圆底烧瓶倾斜的目的是___。
(2)步骤(二)中,当观察到仪器甲中有无色油状液体馏出时,可停止蒸馏。蒸馏结束时,下列操作的顺序为___(填标号)。
①停止加热 ②打开弹簧夹 ③关闭冷凝水
(3)在馏出液中加入食盐的作用是___;加入无水Na2SO4的作用是___。
(4)实验结束后,用稀NaOH溶液清洗冷凝管,反应的化学方程式为___。
(残留物以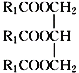 表示)
表示)
(5)为测定花椒油中油脂的含量,取20.00mL花椒油溶于乙醇中,加80.00mL0.5mol/LNaOH的乙醇溶液,搅拌,充分反应,加水配成200mL溶液。取25.00mL加入酚酞,用0.1moI/L盐酸进行滴定,滴定终点消耗盐酸20.00mL。则该花椒油中含有油脂___g/L。
(以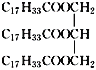 计,式量:884)。
计,式量:884)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为乙酸丁酯制备的实验装置,下列说法正确的是

A.玻璃导管的主要作用是平衡试管内外压强
B.该装置适用于乙酸乙酯的制备
C.加入过量乙酸可以提高丁醇的转化率
D.分离提纯乙酸丁酯的方法是将混合物直接分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列物质:①氢氧化钠溶液、②铝片、③液态HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 气体、⑦碳酸氢钠、 ⑧氧化铝
(1)属于电解质的是______________________。(填编号)
(2)能导电的是____________________________________。(填编号)
(3)①和②反应的离子方程式________________________________。
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。_______________
(2)该反应的还原产物为__________。若反应中消耗1 mol K2Cr2O7,则转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓盐酸和MnO2制Cl2,并以干燥的Cl2为原料进行实验,装置如下图所示。

(1)写出A中反应的化学方程式:_______________________________________。
(2)装置B、C中应盛放的试剂名称分别为_____________、_____________;
(3)实验时,先点燃______________处的酒精灯, F装置所起的作用是:__________(答两点)。
(4)用石灰乳吸收氯气可制得漂白粉,写出工业制漂白粉的化学方程式: ______________,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是______(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】印刷线路板废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl-),可用来制备碱式碳酸铜,过程如图:
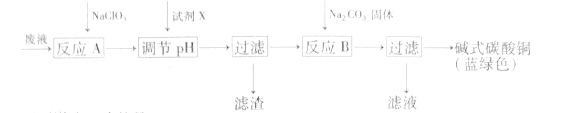
下列说法正确的是( )
A.反应A的离子方程式为:10Fe2++2ClO3-+12H+=10Fe3++Cl2↑+6H2O
B.铜在空气中被腐蚀得到铜锈,其主要成分是碱式碳酸铜
C.NaClO3和Na2CO3中心原子杂化类型均为sp3杂化
D.试剂X可为CuO,主要作用是通过调节pH值把Fe2+转化为Fe(OH)3过滤除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g CH3OH(l)完全燃烧生成液态水和CO2,放出72.576 kJ的热量。下列热化学方程式正确的是
A.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = - 72.576 kJ·mol-1
B.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
O2(g)===CO2(g)+2H2O(g) ΔH = - 72.576 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH = - 1451.52 kJ·mol-1
D.CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH = + 725.76 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种紫黑色固体,只能在碱性环境中稳定存在,在中性或酸性中易分解,工业中通常是先制得高铁酸钠再转化为高铁酸钾。
I.制备NaCIO溶液
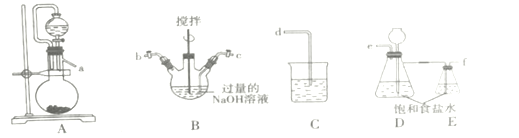
(1)装置的连接顺序为a→___→d。
(2)装置D的作用___。
(3)B装置反应过程中要严格控制温度,温度过高易生成NaClO3,写出生成NaClO3的离子方程式___。
II.制备K2FeO4
(1)湿法制备K2FeO4:将Fe(NO3)3溶液滴加到装置B的混合溶液中,其反应的离子方程式是___。继续向反应后的溶液中加入KOH,会析出紫黑色固体,上述转化能发生的原因是___(用简要的文字说明)。
(2)电解法制备K2FeO4(如图):
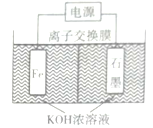
该装置中离子交换膜为___离子交换膜(填“阴”或“阳"),阳极电极反应式为___。
III.K2FeO4性质的探究
取电解后的溶液滴加稀盐酸,收集到黄绿色气体。针对以上现象,甲乙两位同学提出了以下猜想:
甲:气体只含有Cl2。
乙:气体除Cl2外还含有___,请设计实验证明乙同学的猜测___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
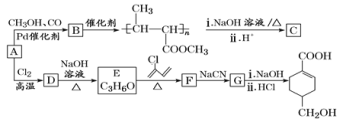
已知:![]() ;R—C
;R—C![]() N
N![]() R—COOH
R—COOH
完成下列填空:
(1)A的名称是__,A一定条件下与水加成,可以得到两种有机物,这两种有机物是__(填“同系物”或“同分异构体”或“同素异形体”)。
(2)C的结构简式为__,D→E的反应类型为__。
(3)E→F的化学方程式为__。
(4)B含有的官能团的名称是__(写名称)。B的同分异构很多,其中相同化学环境的氢原子有三种、比例为6:1:1且能发生银镜反应的是__(写结构简式,任写一种)。
(5)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。__
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com