
在中学化学中铁及其化合物应用广泛,用所学知识回答下列问题。
(1)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去。试分析:
①溶液X含有的金属阳离子应该是 。
②用化学方程式表示上述金属阳离子产生的原因 。
③酸性KMn04溶液紫色褪去的离子方程式为 。
(2)含铬化合物有毒,通常是将废水中+6价铬(如Cr2O2—7)用还原剂还原成Cr3+,再调节溶液pH使Cr3+转化为Cr(OH)3沉淀而除去。工业上有一种电解除Cr2O2—7的方法:将含K2Cr2O7的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。
试分析该电解除Cr2O2—7的方法中:
①阴极的电极反应式为 ;
②电解时加入氯化钠的作用是 ;
③该方法能除去Cr2O2—7的原理是 。
(1)①Fe3+和Fe2+
②2Fe+3Cl2 2FeCl3 2FeCl3+Fe=3FeCl2
2FeCl3 2FeCl3+Fe=3FeCl2
③2MnO4-+5Fe2++16H+=2Mn2++5Fe3++8H2O
(2)①2H++2e-=H2
②增强溶液导电性
③通电时,阳极Fe失去电子生成的Fe2+可还原Cr2O72-,生成的Cr3+在阴极区与OH-结合成氢氧化物沉淀而除去。
解析试题分析:(1) ①“一份加入KSCN溶液时,溶液显红色;另一份中加入酸性KMnO4溶液时,KMnO4溶液紫色褪去”说明X溶液中既有Fe3+又有Fe+,所以溶液X含有的金属阳离子应该是Fe3+和Fe2+。
②2Fe+3Cl2 2FeCl3 2FeCl3+Fe=3FeCl2
2FeCl3 2FeCl3+Fe=3FeCl2
③2MnO4-+5Fe2++16H+=2Mn2++5Fe3++8H2O
(2)①在电解时,阴极得电子,发生还原反应2H++2e-=H2
② 电解时,溶液中的离子在外加电场的作用下要作定向移动,所以加NaCl是为了增强溶液的导电性。
③电解时,活性材料做阳极都是阳极溶解,Fe作阳极,Fe-2e-=Fe2+,
阴极,2H++2e-=H2,水的电离平衡被破坏,阴极区c(OH-)浓度增大。这样,Fe2+可还原Cr2O72-,生成的Cr3+在阴极区与O H-结合成氢氧化物沉淀而除去。
考点:铁及其化合物知识以及电化学知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备 CuSO4·5H2O及纳米材料G,步骤如下:
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为_____(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
向溶液B中加入CuO的作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过 、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)写出制备G的化学反应方程式。若实验过程中有氨气逸出,应选用下列 装置回收(填代号)。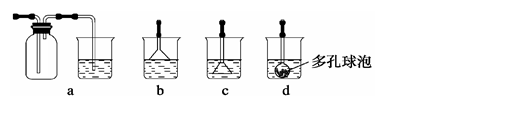
(4)欲测定溶液A中Fe2+的溶液,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金属屑制取新型高效水处理剂Na2FeO4(高铁酸钠)等产品,过程如下:
I.向废金属屑中加入过量的NaOH溶液,充分反应后过滤;
II.向I所得固体中加入过量稀H2SO4,充分反应后过滤;
III.向II所得固体中继续加入热的稀H2SO4,同时不断鼓入空气,固体溶解得CuSO4溶液;
IV.(1)步骤I中发生反应的化学方程式为 、 。
(2)步骤II所得的滤液中加入KSCN溶液无明显现象,表明滤液中不存在Fe3+,用离子方程式解释其
可能的原因 。
(3)步骤III获得CuSO4溶液的离子方程式为 。
(4)步骤II所得滤液经进一步处理可制得Na2FeO4,流程如下:
①测得滤液中c(Fe2+) 为a mol·L-1,若要处理1 m3滤液,理论上需要消耗25 % 的H2O2溶液_________kg
(用含a的代数式表示)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式 ;
(2)n(Mg2+)/ n(Al3+) = ;
(3)C1/C2= ;
(4)所加入NaOH溶液的体积a= mL。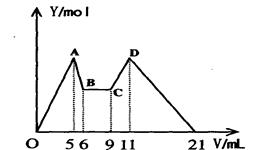
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 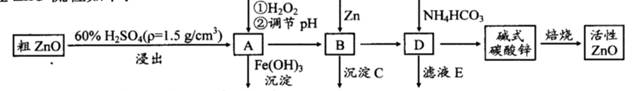
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.4 | 3.1 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O 
(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铜是一种与人类关系非常密切的有色金属。常温下,Cu2+在溶液中稳定,Cu+在酸性条件下易发生歧化反应:2Cu+=Cu2++Cu;大多数+1价铜的化合物是难溶物,如:Cu20、Cul、CuCl、CuH 等。
(1)在CuCl2溶液中逐滴加入过量KI溶液,可能发生的反应有:
2Cu2++4I-=2CuI↓(白色)+I2; 2Cu2++4I-+2Cl-=CuCl↓(白色)+I2
已知:常温下Ksp(CuCl)=1.20×10-6(mol/L)2; Ksp(CuI)=5.06×10-12(mol/L)2。由此推断上述反应生成主要沉淀物的化学式是______。
(2)向CuH中加入过量稀HC1,有气体生成,该反应的离子方程式为______。
(3)将冰铜(由Cu2S和FeS熔合成含Cu 18%—20%的一种物质)加入熔剂,在髙温下吹入空气,冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应生成粗铜。上述两个反应的化学方程式分别是______、______。
(4)常温下,向0.20 mol ? L-1硫酸铜溶液中加入氢氧化钠溶液,生成浅蓝色氢氧化铜沉淀,当溶液的pH = 6时,c(Cu2+)=______mol.L?1。[已知:Ksp(CuI)=2.2×10-20(mol/L)3]
(5)将0.80 gCuSO4 ? 5H2O样品加热分解,其脱水过程中固体质量随温度的变化如下图所示。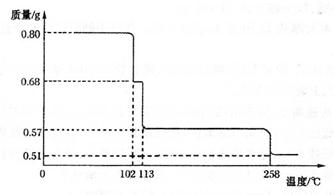
请确定110°C时固体物质的化学式____________。(要求写出推断过程)
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)固体A可用于工业上生产硫酸,各物质间转化如下图。其中C为红棕色粉
末,D为能使品红溶液褪色的无色气体。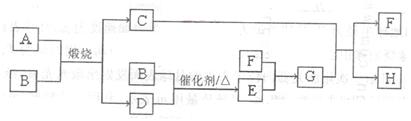
请回答:
(1)F的电子式为_________。
(2)若测得生成C和D的质量比为5:8,则A的化学式为______________。
(3)将D通入H溶液中发生反应的离子方程式为_____________。
(4)物质的量浓度均为0.lmol/L的G和H的混合溶液中,离子浓度由大到小的顺序
为____________。
(5)有人用电解某饱和溶液的方法同时制备G的浓溶液和浓氢氧化钠溶液,如图所
示。则:
①a端为电源的_________(填“正极”或“负极”)。
②N口收集的物质为__________(填化学式,下同。);
Q口收集的为_________浓溶液。
③某物质的饱和溶液最好选用___________(填试剂名称)。
④阳极的电极反应式为____________。
(6)检验H中金属阳离子的方法___________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定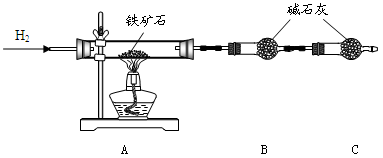
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定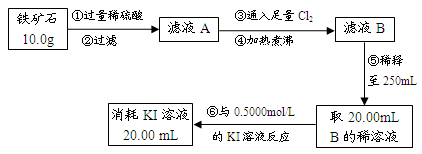
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液A中加入 | | 滤液A中有Fe3+ |
| 步骤2:在滤液A中加入 | | 滤液A中有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com