
| A. | 取该溶液1 mL稀释至100 mL后,pH约等于3 | |
| B. | 向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和 | |
| C. | 该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 | |
| D. | 该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
分析 常温下pH=1的硝酸溶液中c(H+)=0.1mol/L,
A.先计算稀释后溶液中c(H+),再计算溶液的pH;
B.溶液的体积不知道无法计算;
C.溶液中H+为硝酸电离出的H+,水电离出的c(H+)等于水电离出的c(OH-);
D.酸中水电离出的c(H+)等于水电离出的c(OH-).
解答 解:常温下pH=1的硝酸溶液中c(H+)=0.1mol/L,
A.该溶液lmL稀释至100mL后,溶液中c(H+)=0.001mol/L,pH等于3,故A正确;
B.硝酸和氢氧化钡的体积均不知道,无法计算物质的量,无法判断二者谁过量,故B错误;
C.该溶液中硝酸电离出的c(H+)=0.1mol/L,水电离出的c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,二者之比值为1×1012,故C错误;
D.该溶液中水电离出的c(H+)=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH为3的硝酸中水电离出的c(H+)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,二者之比为1:100,故D错误;
故选A.
点评 本题考查了pH的计算,明确酸中水电离出c(H+)的计算方法是解本题关键,再结合弱电解质电离特点分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2,SiO2,P2O5 | B. | PCl3,CO2,H2SO4 | C. | SiC,H2O,NH3 | D. | HF,CO2,Si |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2XO2-在溶液中既可发生电离,又可发生水解 | |
| B. | c(H2XO2-)+c(HXO22-)+c(XO23-)+c(H3XO2)=0.01mol•L-1 | |
| C. | c(H+)=c(OH-)+c(H3XO2) | |
| D. | c(Na+)+c(H+)=c(OH-)+c(H2XO2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH2 | B. | HOCH2-CH2OH | C. | 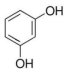 | D. | HCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加热到相同温度时,CH3COONa溶液的pH大 | |
| C. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| D. | 两溶液中由水电离出的c(OH-)之比为$\frac{1{0}^{-5}}{1{0}^{-9}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料.自然界中存在如下氮的循环过程,工业上也可通过一系列的化学反应模拟该过程,实现氮的转化.
氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料.自然界中存在如下氮的循环过程,工业上也可通过一系列的化学反应模拟该过程,实现氮的转化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该分散系的分散质为Fe2O3 | |
| B. | 加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4+4H2O | |
| C. | 在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 | |
| D. | 可用过滤的方法将黑色金属氧化物与Na+分离开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;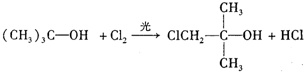 ,反应类型:取代反应;
,反应类型:取代反应; $→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)2+H2O,反应类型:消去反应;
$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)2+H2O,反应类型:消去反应; .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com