
| A.Fe2(SO4)3 | B.ZnSO4 | C.KNO3 | D.NaCl |
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:不详 题型:实验题
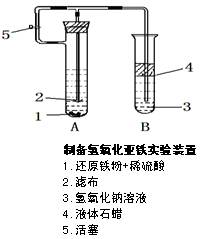
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2Cu+SO2
2Cu+SO2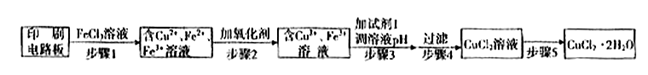 ①证明步骤I所加FeCl3溶液过量的方法是 。
①证明步骤I所加FeCl3溶液过量的方法是 。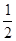 O2(g)==H2O(l) △H3=-286kJ/mol
O2(g)==H2O(l) △H3=-286kJ/mol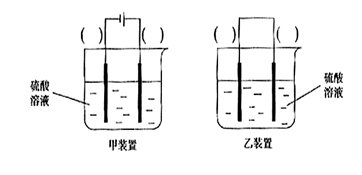
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①或② |
| B.②或④ |
| C.①或②或③ |
| D.上述四种物质中任意一种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.食盐和硫酸 | B.胆矾和石灰水 |
| C.铁粉和生石灰 | D.苏打和硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
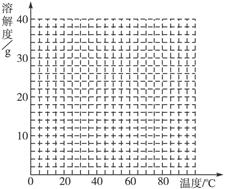
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
| 析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①和② | B.②和③ |
| C.③和④ | D.①和④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.物质的量之比为2:1 | B.物质的量之比为4:1 |
| C.质量之比为1:1 | D.质量之比为3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com