

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 | 8.3 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 9.8 |
分析 碳酸锰矿粉碎加入稀硫酸酸浸,酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,
除杂过程中加入下列物质,
加入MnO2,二氧化锰具有氧化性,能将亚铁离子氧化生成铁离子;
加入CaO将溶液调至pH=5.2~6,根据表中数据知,铁离子、铝离子都转化为沉淀;
加入BaS除去溶液中的Cu2+、Pb2+等,再加入NaF除去Ca2+;
然后过滤,向滤液中加入碳酸氢铵,碳酸氢铵和硫酸锰反应生成碳酸锰和硫酸铵,所以滤液A中含有硫酸铵,将碳酸锰灼烧并通入氧气得到二氧化锰粗产品;
(1)反应物的接触面积越大,反应速率越大;
(2)Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+;加入CaO将溶液的pH调到5.2~6.0,
Fe3+和Al3+分别生成氢氧化铁和氢氧化铝沉淀;再加入BaS,硫酸根和钡离子生成硫酸钡沉淀,Cu2+、Pb2+生成硫化铜和硫化铅沉淀,
浸出液中含有加入的氧化钙生成的钙离子,再加入NaF溶液生成氟化钙沉淀除去;
(3)Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,
c(F-)=$\sqrt{\frac{{K}_{sp}}{c(C{a}^{2+})}}$=$\sqrt{\frac{4.0×1{0}^{-11}}{1{0}^{-5}}}$mol/L=2×10-3 mol/L,
根据m=cVM计算氟离子质量.
(4)从溶液A中回收的主要物质常用作化肥,为硫酸铵,铵根离子水解导致溶液呈酸性;
(5)A.溶液中存在物料守恒,根据物料守恒判断;
B.溶液中存在电荷守恒,根据电荷守恒判断;
C.溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.NH4+水解程度小于HCO3-,导致溶液呈碱性,只有碳酸氢根电离才能生成CO32-,碳酸氢根离子水解及水电离都生成OH-、铵根离子水解及水电离都生成H+.
解答 解:碳酸锰矿粉碎加入稀硫酸酸浸,酸浸后溶液中含有Mn2+、SO42-,另含有少量Fe2+、Fe3+、Al3+、Pb2+、Cu2+等,
除杂过程中加入下列物质,
加入MnO2,二氧化锰具有氧化性,能将亚铁离子氧化生成铁离子;
加入CaO将溶液调至pH=5.2~6,根据表中数据知,铁离子、铝离子都转化为沉淀;
加入BaS除去溶液中的Cu2+、Pb2+等,再加入NaF除去Ca2+;
然后过滤,向滤液中加入碳酸氢铵,碳酸氢铵和硫酸锰反应生成碳酸锰和硫酸铵,所以滤液A中含有硫酸铵,将碳酸锰灼烧并通入氧气得到二氧化锰粗产品;
(1)将碳酸锰矿粉碎可以增大接触面积,加快反应速率,使反应更充分,
故答案为:增大接触面积,加快反应速率(使反应更充分);
(2)①Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,
故答案为:氧化亚铁离子得到铁离子;
②加入CaO将溶液的pH调到5.2~6.0,Fe3+和Al3+分别生成氢氧化铁和氢氧化铝沉淀;
故答案为:Fe(OH)3、Al(OH)3;
③加入BaS,硫酸根和钡离子生成硫酸钡沉淀,Cu2+、Pb2+生成硫化铜和硫化铅沉淀,浸出液中含有加入的氧化钙生成的钙离子,再加入NaF溶液生成氟化钙沉淀除去;
故答案为:Cu2+、Pb2+;
(3)Ksp(CaF2)=4.0×10-11,计算当溶液中Ca2+完全沉淀[c(Ca2+)<10-5mol/L]后,
c(F-)=$\sqrt{\frac{{K}_{sp}}{c(C{a}^{2+})}}$=$\sqrt{\frac{4.0×1{0}^{-11}}{1{0}^{-5}}}$mol/L=2×10-3 mol/L,
m(F-)=cVM=2×10-3 mol/L×1000L×19g/mol=38g,
故答案为:38g.
(4)溶液中作化肥的物质为硫酸铵,铵根离子水解导致溶液呈酸性,水解离子方程式为NH4++H2O?NH3.H2O+H+,
故答案为:NH4++H2O?NH3.H2O+H+;
(5)A.溶液中存在物料守恒,根据物料守恒得c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),故A正确;
B.溶液中存在电荷守恒,根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
,故B错误;
C.溶液中存在电荷守恒和物料守恒,根据物料守恒得c(NH4+)+c(NH3•H2O)=c(HCO3-)+c(CO32-)+c(H2CO3),根据电荷守恒得c(NH4+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-)
,所以得c(OH-)+c(NH3•H2O)=c(H+)+c(H2CO3)-c(CO32-),故C正确;
D.NH4+水解程度小于HCO3-,导致溶液呈碱性,只有碳酸氢根电离才能生成CO32-,碳酸氢根离子水解及水电离都生成OH-、铵根离子水解及水电离都生成H+,所以离子浓度大小顺序是(NH4+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),故D错误;
故选AC.
点评 本题考查了物质分离提纯,为高频考点,涉及盐类水解、难溶物的溶解平衡、物质分离和提纯等知识点,明确化学反应原理及物质性质是解本题关键,侧重考查学生分析判断及综合知识灵活运用能力,注意分析流程图中发生的反应及溶液中溶质成分,题目难度中等.


 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:多选题
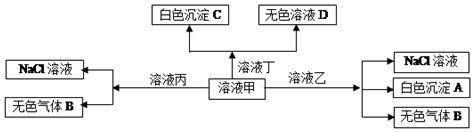
| A. | 在甲中滴加丁开始反应的离子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出 | |
| B. | 若X为直流电源,Y为碳棒接负极,则Fe棒被保护 | |
| C. | 若X为电流计,Y为锌棒,则SO42-移向Fe棒 | |
| D. | 若X为导线,Y为铜棒,则Fe棒发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
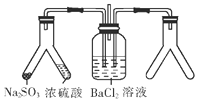
| A. | 大理石和稀盐酸 | B. | CaO和浓氨水 | C. | Cu和浓硝酸 | D. | MnO2和双氧水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com