
分析 (1)碘和碘离子反应生成I3-,碘在四氯化碳中呈紫色,I3-呈无色;
(2)NaCl和硝酸银反应生成AgCl白色沉淀,AgCl和反应生成络合物Ag(NH3)2Cl;
(3)Fe3+和SCN-反应生成络合物而使溶液呈血红色;
(4)硫酸铜和一水合氨发生复分解反应生成Cu(OH)2蓝色沉淀,Cu(OH)2和一水合氨反应生成络合物[Cu(NH3)4]2+,得到透明深蓝色溶液,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出深蓝色晶体[Cu(NH3)4]SO4.
解答 解:(1)碘在四氯化碳中呈紫色,碘和碘离子发生氧化还原反应生成I3-,I3-呈无色,所以看到的现象是:溶液紫色变浅,离子反应方程式为I2+I-=I3-,故答案为:紫色变浅;I2+I-=I3-;
(2)NaCl和硝酸银反应生成AgCl白色沉淀,AgCl和反应生成络合物Ag(NH3)2Cl,沉淀溶解方程式为AgCl+2NH3.H2O=Ag(NH3)2Cl+2H2O,
故答案为:AgCl+2NH3.H2O=Ag(NH3)2Cl+2H2O;
(3)Fe3+和SCN-反应生成络合物而使溶液呈血红色,看到的现象是溶液变为血红色,离子方程式为Fe3++3SCN-=Fe(SCN)3 ,
故答案为:溶液变为血红色;Fe3++3SCN-=Fe(SCN)3 ;
(4)硫酸铜和一水合氨发生复分解反应生成Cu(OH)2蓝色沉淀,离子反应方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,Cu(OH)2和一水合氨反应生成络合物[Cu(NH3)4]2+,得到透明蓝色溶液,离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,[Cu(NH3)4]SO4在乙醇中的溶解度小于在水中的溶解度,向溶液中加入乙醇后会析出深蓝色晶体[Cu(NH3)4]SO4,
故答案为:深蓝色;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;深蓝色.
点评 本题考查配合物的有关化学方程式、离子方程式,明确物质的性质及物质之间的反应是解本题关键,知道铁离子的检验方法及实验现象,难点是配合物离子方程式的书写.


科目:高中化学 来源: 题型:选择题
| [H2]/mol•L-1 | [Cl2]/mol•L-1 | v/mol•L-1•s-1 |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
| A. | m=1、n=1 | B. | m=$\frac{1}{2}$、n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$、n=1 | D. | m=1、n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
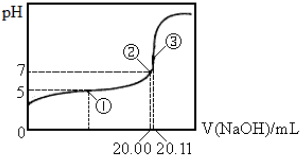
| A. | 该温度下CH3COOH的电离平衡常数约为1.8×10-5 | |
| B. | 点①处溶液中c(CH3COO-)<c(CH3COOH) | |
| C. | 点③处溶液中c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(OH-)>c(Na+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
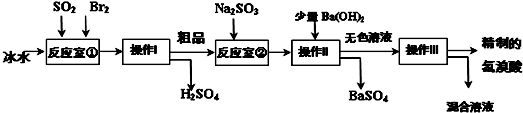
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;
(1)拆开1mol H-H键、1mol N-H键、1mol N=N键分别需要吸收的能量为436KJ,391KJ,946KJ,求:则①1molN2生成NH3需要放出(吸收或放出)热量92KJ;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 达到平衡时X浓度为0.04 mol•L-1 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015 mol•L-1 | |
| C. | 若升高温度,X的体积分数增大,则该反应的?△H<0 | |
| D. | 若增大压强,平衡向正反应方向移动,平衡常数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
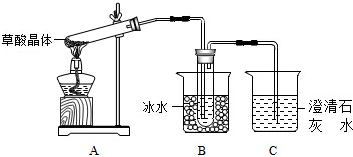

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com