
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
| 平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
| 反应物转化率 | a1 | a2 | a3 | |
| 体系压强(Pa) | p1 | P2 | P3 | |

分析 (1)利用三段法计算出平衡时各物质的浓度,再计算平衡常数,然后利用Q与K的关系来分析平衡的移动;
(2)可假设反应正向进行或逆向进行达到平衡,并结合可逆反应的限度来判断即可;
(3)甲容器反应物投入1molN2、3molH2,乙容器反应物投入量2molNH3,恒温且乙容器容积和甲容器相同,则甲容器与乙容器是等效平衡;
甲容器反应物投入1molN2、3molH2,丙容器反应物投入量4molNH3,采用极限转化法转化为反应物为2molN2、6molH2,是甲中的二倍,如果恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡;所以丙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡;据此分析平衡移动;
(4)打开K2,一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,根据恒温恒压下体积之比等于物质的量之比计算平衡时气体体积,减去A容器体积即为B的体积.
解答 解:(1)由10amolH2和30amolN2放入2L的密闭容器中,充分反应后测得N2的转化率为60%,则
N2 +3H2 ?2NH3
开始mol/L 5a 15a 0
变化mol/L 5a×60%=3a 9a 6a
平衡mol/L 2a 6a 6a
平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(6a)^{2}}{(2a)×(6a)^{3}}$=$\frac{1}{12{a}^{2}}$;
若此时再向该容器中投入10amolN2、20amolH2和20amolNH3,三者的浓度分别为:7amol/L、16amol/L、16amol/L;则Q=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(16a)^{2}}{(7a)×(16a)^{3}}$=$\frac{1}{112{a}^{2}}$<K,此时平衡正向进行;
故答案为:$\frac{1}{12{a}^{2}}$;正向移动;
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,假设反应正向进行,则N2的最大转化浓度为0.1mol/L,则NH3的变化浓度为0.2mol/L,即平衡时NH3的浓度小于0.3mol/L,假设反应逆向进行,则NH3的变化浓度最大为0.1mol/L,即平衡时NH3的最小浓度为大于0mol/L,故NH3达到平衡时浓度的范围为0mol/L<c(NH3)<0.3mol/L;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,如果反应是从反应物方向开始的,NH3的起始浓度为0mol/L,如果反应是生成物方向进行的,生成0.1mol/LN2时消耗NH3的浓度分别为0.05mol/L,NH3的起始浓度为0.15mol/L,NH3起始时浓度的范围为0mol/L≤c(NH3)≤0.3mol/L;
故答案为:0mol/L<c(NH3)<0.3mol/L;0mol/L≤c(NH3)≤0.3mol/L;
(3)甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,Q1+Q2=92.4;甲投入1molN2、3molH2,乙中投入2molNH3,则甲与乙是完全等效的,所以转化率α1+α2=1;丙容器反应物投入量4molNH3,是乙的二倍,若平衡不移动,丙中压强为乙的二倍;由于丙中相当于增大压强,平衡向着向着正向移动,所以丙中压强减小,小于乙的2倍,即2p2>p3;
故答案为:92.4;=;>;
(4)打开K2,一段时间又达到平衡时,等效为开始通入3molN2和9molH2再恒温恒容到达的平衡,与B中平衡为等效平衡,平衡时同种物质的转化率相等,则平衡时混合气体物质的量为B中平衡时的3倍,恒温恒压下体积之比等于物质的量之比,故平衡时气体体积为0.9 L×3=2.7L,则B的体积为2.7 L-1L=1.7L,
故答案为:1.7.
点评 本题考查化学平衡计算与影响因素、平衡状态判断、化学平衡图象、等效平衡、化学平衡的计算,题目计算量较大,综合性强,题目难度较大,关键是构建平衡建立的等效途径,试题侧重对学生灵活运用基础知识解决实际问题的能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量相等的O2和O3 | B. | 原子数目相等的CO和N2 | ||
| C. | 电子数目相等的O2和N2 | D. | 等压、等体积的N2和CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的CO2通入Ca(ClO)2溶液中 2ClO-+CO2+H2O═CO32-+2HClO | |
| B. | AgNO3溶液滴入少量的Na2S溶液 2Ag++S2-═Ag2S↓ | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+═CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO3溶液2HSO3-+Ba2++2OH-═BaSO3↓+SO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )
绿原酸被誉为“第七类营养素”,具有广泛的杀菌、消炎功能,其结构简式如图所示.下列有关绿原酸的说法中正确的是( )| A. | 绿原酸分子中含有3种官能团 | |
| B. | 1 mol绿原酸最多能与7molNaOH发生反应 | |
| C. | 绿原酸能发生取代反应、加成反应和消去反应 | |
| D. | 绿原酸能使酸性高锰酸钾溶液、浓溴水褪色,反应原理同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | C-C | C═C | C-H | H-H |
| 键能/(kJ•mol-1) | 348 | 610 | 413 | 436 |
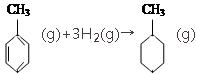 的焓变
的焓变| A. | ①②③④ | B. | ③④⑤ | C. | ④⑤ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液与醋酸反应 | B. | 氢氧化钙与稀盐酸反应 | ||
| C. | 氢氧化钡与稀硫酸反应 | D. | 氢氧化钾与稀硝酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每生成1mol Fe3O4转移4mol电子 | |
| B. | 该反应中Fe2+和S2O32-都是还原剂 | |
| C. | 3mol Fe2+被氧化时有1molO2被还原 | |
| D. | 反应方程式中化学计量数x=4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com