
分析 (1)反应达到平衡时有10%的N2转化,故氮气的浓度变化量为4mol/L×10%=0.4mol/L,根据三段式计算平衡时N2、H2和NH3的浓度;
(2)根据(1)的计算,结合平衡时NH3占总体积百分数氨气平衡浓度除以混合气体总浓度计算.
解答 解:(1)反应达到平衡时有10%的N2转化,故氮气的浓度变化量为4mol/L×10%=0.4mol/L,则:
N2+3H2?2NH3
开始(mol/L):4 8 0
变化(mol/L):0.4 1.2 0.8
平衡(mol/L):3.6 6.8 0.8
故平衡时N2、H2和NH3的浓度分别为3.6mol/L、6.8mol/L、0.8mol/L,
答:平衡时N2、H2和NH3的浓度分别为3.6mol/L、6.8mol/L、0.8mol/L;
(2)平衡时NH3占总体积百分数为:$\frac{0.8mol/L}{3.6mol/L+6.8mol/L+0.8mol/L}$×100%=7.1%,
答:平衡时NH3占总体积百分数为7.1%.
点评 本题考查化学平衡的有关计算,难度不大,注意三段式解题法的利用,掌握解题方法和概念实质是解题关键.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:解答题
 的系统命名2-甲基-3-乙基己烷
的系统命名2-甲基-3-乙基己烷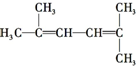
 的键线式:
的键线式:
 中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.
中,共平面的碳原子最多有13个,该分子中有4种不同化学环境的H原子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的转化率是60% | B. | 该反应的平衡常数 是12.5 | ||
| C. | 平衡时总物质的量是2.6mol | D. | 平衡时气体的密度是15.6g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:
已知一定温度和压强下,在起始容积为V L的容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g)+B(g)?C(g)△H>0.达到平衡时,C的体积分数为40%.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 增大压强使平衡向生成Z的方向移动,平衡常数增大 | |
| B. | 反应可表示为X+3Y?2Z,其平衡常数为1600 | |
| C. | 反应达到平衡时,X的转化率为50% | |
| D. | 改变温度可以改变此反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | CO(g)的燃烧热是283.0 kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+2×283.0 kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g);△H12C(s)+O2(g)=2CO(g);△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、食盐 | B. | HNO3、Ba(OH)2、CaO | ||
| C. | 碳酸,烧碱,葡萄糖 | D. | HCl,Ca(OH)2,NH4HSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com