
硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果不正确的是( )
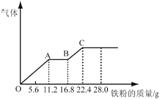 A.混合酸中HNO3物质的量浓度为2 mol·L-1
A.混合酸中HNO3物质的量浓度为2 mol·L-1
B.原混合酸中H2SO4物质的量为0.4 mol
C.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,
BC段产生氢气
D.第二份溶液中最终溶质为FeSO4
【知识点】金属的性质 硝酸的性质 C3 D4
【答案解析】B 解析:A、OA段发生反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O,硝酸全部起氧化剂作用,故原混合液中n(NO3-)=2n(Fe)=2×11.2/56=0.4mol,混合酸中HNO3物质的量浓度为0.4mol÷0.2L=2mol/L,故A正确;B、第二份反应消耗22.4g铁,物质的量为22.4g÷56g/mol=0.4mol,所有的铁都在硫酸亚铁中,根据硫酸根守恒,所以每份含硫酸0.4mol,所原混合酸中H2SO4物质的量为0.4 mol×2=0.8mol,故B错误;C、由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+═Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+═3Fe2+,BC段发生反应为:Fe+2H+═Fe2++H2↑,故C正确;D、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为FeSO4,故D正确。
故答案选B
【思路点拨】本题考查金属和酸反应的计算题,难度较大,关键根据图象分析各段发生的反应,注意与铁的反应中硝酸全部起氧化剂作用.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,不能达到实验目的的是 ( )
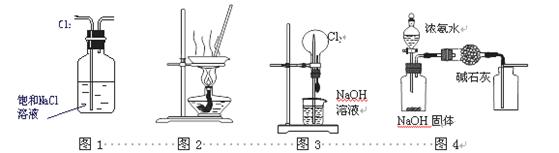
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸发KCl溶液制备无水KCl
C.用图3所示装置可以完成“喷泉”实验
D.用图4所示装置制取干燥纯净的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
利用反应Cu+2FeCl3===CuCl2+2FeCl2组成一个化学电池。
(1)指出正极为________,电极反应式为__________________________________;负极为____________,电极反应式为____________________________。
(2)若电池内溶液为100 mL 0.5 mol/L的FeCl3溶液;当溶液中FeCl3全部被还原成FeCl2时,溶液中CuCl2的物质的量浓度是________,导线上通过的电子是________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。
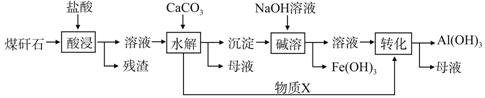
(1)写出“酸浸”过程中主要反应的离子方程式(任写一个):
。
(2)物质X的化学式为________。“碱溶”时反应的离子方程式为__________________。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al(OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,再加入CaCO3调节pH到5.4,过滤得到Al(OH)3
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向AlCl3饱和溶液中不断通入HCl气体,可析出大量AlCl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
有关Fe及其化合物的部分转化关系如图所示。下列说法不正确的是
A.①中硫酸的浓度可以为98% B.②中试剂可以是氨水或NaOH溶液
C.③中操作为蒸发浓缩、冷却结晶 D.X一定含有SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
新型材料纳米级铁粉与普通铁粉具有不同的性质。已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4。
(1)写出温度低于570℃时反应的化学方程式 。
(2)中学教材中用右图所示实验装置,完成铁粉与水蒸气反应的演示实验。实验中使用肥皂液的作用是
。
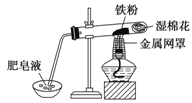
(3)如果提供给你3支试管、水槽、蒸发皿、胶塞、导管、酒精灯及其必要的仪器和物品,请在答题卷的方框中画出你设计的实验装置示意图发生该反应并有氢气的收集装置图(包括反应时容器中的物质)。
 |
说明:①本题装置示意图中的仪器可以用下面的方式表示。
水槽:
 试管:
试管:
 蒸发皿:
蒸发皿:
 玻璃导管:
玻璃导管:
 或
或
 (但应标示出在液面上或液面下)
(但应标示出在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的联接胶管等,在示意图中不必画出。如需加热,在需加热的仪器下方,标以“△”表示。
(4)乙同学为了探究实验后的固体产物是否存在Fe3O4(假定铁全部反应完全)设计下列实验方案:
①取固体样品m1 g,溶于足量的稀盐酸;
②向①反应后的溶液X中加入足量H2O2的和氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2 g。
溶液X中发生氧化还原反应的离子方程式为 ;m1与m2符合 关系时,才能确定固体样品中一定只存在Fe3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据陈述的知识,类推得出的结论正确的是
A.镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O
B. Fe与S直接化合生成FeS,则Cu与S直接化合生成Cu2S
C.少量CO2通入Ca(ClO)2溶液生成CaCO3,则少量SO2通入Ca(ClO)2溶液生成CaSO3
D. 已知第四主族沸点CH4<SiH4<GeH4,则第六主族沸点H2O<H2S<H2Se
查看答案和解析>>
科目:高中化学 来源: 题型:
M5纤维是近年来开发出的一种超高性能纤维,它比现有的防爆破材料轻35%,用它制成的头盔、防弹背心和刚性前后防护板,能为武装人员提供更多的生命保障。下面是M5纤维的合成路线(部分反应未注明条件):
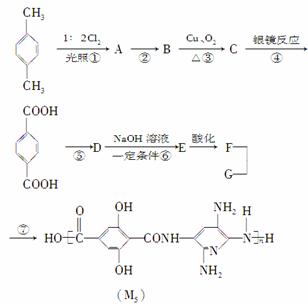
已知:当反应条件为光照且与X2反应时,通常是X2与烷烃基或苯环侧链烃基上的氢原子发生取代反应,而当反应条件为催化剂存在且与X2反应时,通常为苯环上的氢原子直接被取代。
根据上述合成M5纤维的过程,完成下列问题:
(1)合成M5纤维的单体G的结构简式为
________________________________________________________________________
________________________________________________________________________,
F的含氧官能团的名称有
________________________________________________________________________。
(2)在①~⑦的反应中,不属于取代反应的是______________,②的反应条件是
________________________________________________________________________。
(3)生成A的同时可能生成的A的同分异构体为
________________________________________________________________________。
(4)1 mol的C和足量新制的氢氧化铜悬浊液反应可以生成________ mol砖红色沉淀。
(5)1 mol F和Na2CO3溶液反应最多消耗Na2CO3______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com