
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 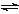 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
科目:高中化学 来源: 题型:
科学家成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2原子晶体的说法正确的是( )
A.CO2原子晶体和分子晶体互为同素异形体
B.在一定条件下,CO2原子晶体转化为分子晶体是物理变化
C.CO2原子晶体和CO2分子晶体具有相同的物理性质
D.在CO2原子晶体中,每一个碳原子周围结合四个氧原子,每个氧原子跟两个碳原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
在盐的水解过程中,下列叙述正确的是( )
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.含有弱酸根离子的盐的水溶液一定显碱性
D.盐的水解程度主要取决于盐本身的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中比值为2:1的是( )
A. pH值均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比
B. (NH4)2SO4溶液中c(NH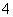 )与c(SO
)与c(SO )之比
)之比
C.相同温度下,0.2 mol·L-1的CH3COOH溶液与0.1 mol·L-1的CH3COOH溶液的c(H+)之比
D. 100 mL 0.2 mol·L-1的HCl与100 mL 0.1 mol·L-1的HF溶液中c(H+)之比
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
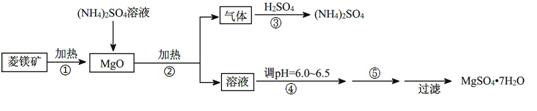 (1)步骤②中发生反应的离子方程式为 。
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
[25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
|
| B. | 在标准状况下,80g SO3所占的体积约为22.4L |
|
| C. | 常温下,0.1mol•L﹣1醋酸溶液的pH约为1 |
|
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
|
| A. | 3.4mol/L | B. | 0.2mol/L | C. | 1.8mol/L | D. | 3.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
美国化学家R.H. Heck因发现如下Heck反应而获得2010年诺贝尔化学奖。

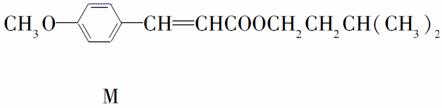
回答下列问题:
(1)M可发生的反应类型是________。
a.取代反应 b.酯化反应
C.缩聚反应 d.加成反应
(2)C与浓H2SO4共热生成F,F能使酸性KMnO4溶液褪色,F的结构简式是__________________________。D在一定条件下反应生成高分子化合物G,G的结构简式是__________________________________。
(3)在A→B的反应中,检验A是否反应完全的试剂是________________________________________。
(4)E的一种同分异构体K符合下列条件:苯环上有两个取代基且苯环上只有两种不同化学环境的氢,与FeCl3溶液作用显紫色。K与过量NaOH溶液共热,发生反应的方程式为________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com