
由尿中分离出来的化合物A,熔点为187℃~188℃。对化合物A作如下实验:(1)测得A的蒸气密度为8.0g/L(已折合成标况状况)。取17.92gA完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10g。剩余气体通过碱石灰,气体质量减轻39.60g,另取17.92gA完全分解,可得1.12L(标况)氮气。试通过计算确定A的分子式。
(2)又已知A和足量6mol/L的盐酸混合加热可以完全水解,1molA水解生成1molB和1molC。已知:A、B、C三种物质的分子中均含有一个羧基;B物质仅由C、H、O三种元素组成,其物质的量之比7∶6∶2;C的俗名为甘氨酸。写出A、B、C的结构简式:A____________;B____________;C____________。
(1)M(A)=8.0g/L×22.4L?mol-1=179.2g?mol-1
n(A)=17.92g/179.2g?mol-1=0.10mol
n(N2)=1.12l/22.4l?mol-1=0.05mol
n(CO2)=39.6g/44g?mol-1=0.90mol
n(H2O)=8.1g/18g?mol-1=0.45mol
∴1molA中含9molC原子 9molH原子1molN原子
O的物质的量(179.2-9×12-9×1-1×14)g/16g?mol-1=3mol
∴A的化学式为C6H9O3N
(2)A.![]() B.
B.![]() C.
C.![]()
∵B中n(C)∶n(H)∶n(O)=7∶6∶2,且有一个羧基即有2个氧原子)
∴B的化学式C7H6O2


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| △ |
| ||
| △ |
| 高温、高压 |
| 催化剂 |
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(NH3) | n(CO2) |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省八市高三三月联考理综化学试卷(解析版) 题型:填空题
氮元素及其化合物在国防科学技术生产中有重要应用。
(1)写出实验室制NH3的化学反应方程式 ???????????
(2)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,氢气的来源是水和碳氢化合物,写出以天然气为原料制取氢气的化学反应方程式 ?? 。
(3)在合成氨的原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ???????????????????????????? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
CO2 (g)+ H2 (g) △H<0,反应达到平衡后,为提高CO的转化率,可采取的措施有 ???????????????????????????? ,已知1000K时该反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始物中,c(H2O)﹕c(CO)不低于 ,
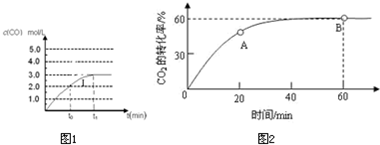
(4)在容积为2L容器中发生反应CO(g)+H2O(g) CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ
CO2 (g)+ H2 (g),已知c(CO)与反应时间t变化曲线Ⅰ

若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(CO)与反应时间t变化曲线Ⅱ
(5)工业上尿素CO(NH2)2由CO2和NH3在一定条件下合成,其化学反应方程式为
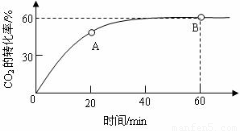
(6)合成尿素时,当氨碳比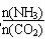 =4,CO2的转化率随时间的变化关系如右图所示.
=4,CO2的转化率随时间的变化关系如右图所示.
①A点的逆反应速率v逆(CO2) B点的正反应速率为v正(CO2)(填“>”、“<”或“=”)
②NH3的平衡转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com