
| A. | 大于10.00mL | B. | 小于10.00mL | C. | 等于10.00mL | D. | 等于11.00mL |
科目:高中化学 来源: 题型:选择题
| A. | (m-0.1)g | B. | (m-0.8)g | C. | (m-1.2)g | D. | (m-1.6)g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
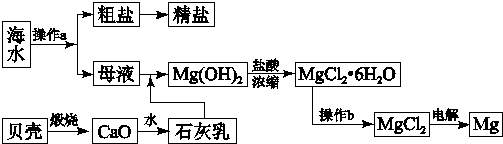
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将(NH4)2SO4、CuSO4溶液分别加入蛋白质溶液,都出现沉淀,表明二者均可使蛋白质变性 | |
| B. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| C. | 用水可以鉴别乙醇、甲苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可以鉴别苯、环已烯和环已烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
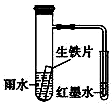 如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )
如图装置中,小试管内为红墨水,具支试管内盛有一定量pH=4的雨水和生铁片.实验时观察到:开始时导管内液面下降,一段时间后导管内液面回升,略高于小试管内液面.下列说法正确的是( )| A. | 生铁片中的碳是原电池的阳极,发生还原反应 | |
| B. | 雨水酸性较强,生铁片仅发生析氢腐蚀 | |
| C. | 墨水液面回升时,碳电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 具支试管中溶液pH逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 14 | C. | 17 | D. | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6 g CO和22.4 L CO2中含有的碳原子数一定相等 | |
| B. | n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为$\frac{35.5m}{n}$ | |
| C. | 标准状况下,11.2L M气体分子的质量为16 g,则M气体的摩尔质量是32 | |
| D. | 现有CO、CO2、O3三种气体,它们均含有1 mol O,则三种气体的物质的量之比为3:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com