
| A. | 建筑要使用大量的沙,常使用内陆河的河沙及海洋的海沙 | |
| B. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不相同 | |
| D. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 |
分析 A.不能使用海沙做建筑材料,防止钢铁发生腐蚀;
B.依据次氯酸根离子与氯离子酸性环境下发生归中反应生成氯气解答;
C.漂白粉生成具有强氧化性的次氯酸,明矾水解生成具有吸附性的氢氧化铝;
D.根据绿色化学的核心的概念.
解答 解:A.因为海沙盐分高,极易使建筑工程出现氯离子腐蚀钢筋情况,造成安全隐患,故A错误;
B.次氯酸根离子与氯离子酸性环境下发生归中反应生成氯气,氯气有毒,故B正确;
C.漂白粉生成具有强氧化性的次氯酸,能消毒杀菌,明矾水解生成具有吸附性的氢氧化铝,能起到吸附悬浮杂质的作用,做净水剂,二者原理不同,故C正确;
D.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染,故D正确;
故选:A.
点评 本题考查较为综合,综合考查元素化合物知识,侧重于化学与生活、生产、环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
| 族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
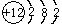 ;
;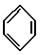 ,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)
,常用作有机溶剂.该有机物分子式为 C6H6 ,其中碳元素与氢元素的质量比m(C):m(H)=12:1(相对原子质量:H-1 C-12)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
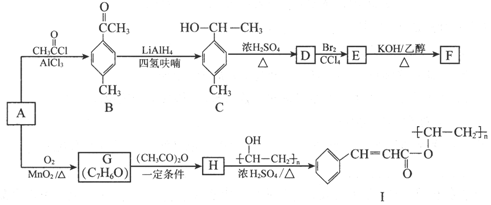
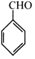
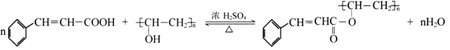
 (写出其中一种的结构简式).
(写出其中一种的结构简式).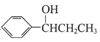 的合成路线
的合成路线 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
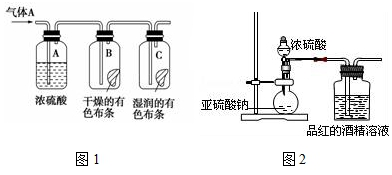
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液中可能大量存在:H+、Cl-、MnO${\;}_{4}^{-}$ | |
| B. | 室温下由水电离的 c(OH-)=1×10-12mol•L-1的溶液中能大量共存:K+、Na+、Cl-、HCO3- | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2 Br2+6 Cl- | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO${\;}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 产生氯气1.792L | B. | 生成AgCl沉淀11.7g | ||
| C. | 被还原的HCl为0.16mol | D. | 转移的电子数为0.16个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com