
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
| A、足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO-=HClO+HSO3- |
| B、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、26.3% |
| B、73.7% |
| C、88.2% |
| D、95.1% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ | |||
B、 +HNO3 +HNO3
 +H2O +H2O | |||
C、CH3CH=CH2+Br2→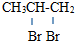 | |||
| D、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH4 |
| B、C3H4 |
| C、C3H6 |
| D、C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、葡萄糖注射液不能产生丁达尔效应现象,不属于胶体 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、纯碱可用于生产普通玻璃,日常生活中也可用纯碱溶液来除去物品表面的油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘化铵和氯化铵受热分解过程中破坏和形成的化学键类型完全相同 |
| B、反应N2H4(l)=N2(g)+2H2(g)是一个△S>0的反应 |
| C、1 mol FeCl3完全水解得到的Fe(OH)3胶体中胶粒数目为NA(NA为阿伏加德罗常数) |
| D、HClO是弱酸,所以NaClO是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com