
| A. | 加入少量CuSO4溶液 | B. | 加入少量K2SO4溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 将稀硫酸换为浓硫酸 |
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | a |
| A | B | C | D | |
| c(CO2) | 3 | 1 | 0.8 | 1 |
| c(H2) | 2 | 1 | 0.8 | 1 |
| c(CO) | 1 | 2 | 3 | 0.5 |
| c(H2O) | 2 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=4 | B. | C(H+)=1×10-3 mol•L-1 | ||
| C. | C(OH-)=1×10-12 | D. | C(H+)/C(OH-)=1012 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
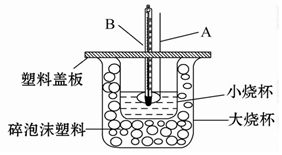
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO32-、Cl-、OH- | B. | Cl-、OH-、CO32- | C. | OH-、Cl-、CO32- | D. | CO32-、OH-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
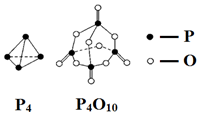
| A. | -(6a-12b-4c+5d)kJ•mol-1 | B. | -(-6a+12b+4c-5d)kJ•mol-1 | ||
| C. | -(-4a+6b+4c-5d)kJ•mol-1 | D. | -(4a-6b-4c+5d)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )
用已知浓度的NaOH溶液测定H2SO4溶液的浓度,所选用的滴定管如图甲、乙所示,从下表中选出正确选项( )| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A. | 碱 | 酸 | 石蕊 | 乙 |
| B. | 酸 | 碱 | 酚酞 | 甲 |
| C. | 碱 | 酸 | 甲基橙 | 乙 |
| D. | 酸 | 碱 | 酚酞 | 乙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com