
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
(12分 (每小题3分)(1)50% (2)1 (3)2 (4)C
解析试题分析:(1)根据图像可知,乙中平衡时A的浓度是0.5mol/L,所以消耗A的浓度是1mol/L-0.5mol/L=0.5mol/L,则消耗B的浓度是0.5mol/L,因此乙中B的转化率是0.5÷1=50%。
(2)甲相当于在乙的基础上压缩容器容积,应用瞬间A的浓度变为原来的2倍,但最终平衡时A的浓度小于1mol/L,这说明增大压强平衡向正反应方向移动,即正反应是体积减小的,所以x只能是等于1。
(3)乙中平衡时三种物质的浓度都是0.5mol/L,所以该反应的平衡常数K=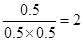
(4)向平衡后的乙容器中充入氦气,压强增大,但反应物的浓度不变,平衡不移动,A不正确;正反应是放热反应,升高温度平衡向逆反应方向移动,所以将乙容器单独升温不可能使乙容器内各物质的体积分数与甲容器内的相同,B正确;若向甲容器中再充入2 mol A、2 mol B,则相当于是在甲的基础上增大压强,平衡向正反应方向移动,所以根据勒夏特列原理可知,最终平衡时平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1。
考点:考查可逆反应、平衡常数的有关计算、外界条件对平衡状态的影响等
点评:由于压强对平衡状态的影响是通过改变浓度实现的,所以在判断压强对平衡状态的压缩时,需要注意的时,压强的变化是否引起反应物的浓度变化,如果浓度不变,则即使压强增大,平衡状态也不影响。在判断时需要特别注意,需要具体问题具体分析。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2011-2012学年安徽省舒城晓天中学高二下学期质量测试3化学试卷(带解析) 题型:填空题
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示: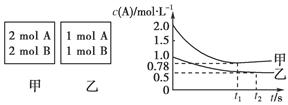
回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014届安徽省高二第二次月考化学试卷(解析版) 题型:计算题
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2013届安徽省高二下学期质量测试3化学试卷(解析版) 题型:填空题
(12分)向甲乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2
mol B和1 mol A、1 mol B。相同条件下(温度T ℃),发生下列反应:A(g)+B(g)? ?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:
?xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示:

回答下列问题:
(1)乙容器中,平衡后物质B的转化率________;
(2)x=________;
(3)T ℃时该反应的平衡常数为________;
(4)下列说法正确的是________。
A.向平衡后的乙容器中充入氦气可使c(A)增大
B.将乙容器单独升温可使乙容器内各物质的体积分数与甲容器内的相同
C.若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2012届江西省南昌一中高三11月月考化学试卷 题型:实验题
(12分)
Ⅰ.(3分)化学反应经常伴随着颜色变化,下列有关反应显示的颜色正确的有
①氢氧化亚铁在空气中最终变为灰绿色; ②淀粉溶液遇碘化钾变为蓝色;
③向硫酸铁溶液中加入KSCN变为红色 ④品红溶液通入过量氯气后褪色
⑤无水硫酸铜吸收水蒸气变成浅绿色; ⑥新制氯水久置后变为无色;
Ⅱ.(9分)某化学实验小组同学为了证明、比较SO2和氯水的漂白性,设计了如下图所示的实验装置。
(1) 实验室常选用制CO2的发生装置制SO2;实验室在用MnO2跟浓盐酸反应制备Cl2时,应选用上图A、E两发生装置中 装置(填装置序号)制Cl2。在制Cl2的反应中MnO2表现出的性质是 。
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给B、D两个
试管加热,两个试管中的现象分别为B: ,D: 。
(3) 装置C的作用是 。
(4) 甲乙两同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是: 。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是: ,并写出其相应的离子方程式: 。
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,其原因是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com