
| A. | NaOH溶液 | B. | 新制的Cu(OH)2悬浊液 | ||
| C. | 碘水 | D. | 溴水 |
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊溶液变红的溶液中:MnO4-、NO3-、SO42-、Na+、SO32- | |
| B. | 加入Al能放出H2的溶液中:Mg2+、NH4+、Cl-、Na+、SO42- | |
| C. | 使pH试纸变深蓝的溶液中:CO32-、NO3-、Na+、S2-、AlO2-、SO32- | |
| D. | pH=1的溶液中:Fe2+、Al3+、NO3-、I-、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | P3>P4,y轴表示A的转化率 | |
| B. | P3>P4,y轴表示B的质量分数 | |
| C. | P3>P4,y轴表示混合气体密度 | |
| D. | P3<P4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
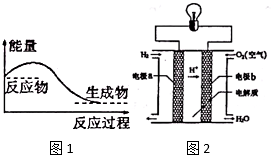 能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能盘是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的比例模型: | |
| B. | 甲基的电子式: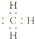 | |
| C. | 乙醇的分子式:C2H4O | |
| D. | 中子数为53、质子数为78的碘原子:${\;}_{53}^{153}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片表面有气泡生成 | |
| B. | 该装置能使化学能直接转变为光能 | |
| C. | 如果将硫酸换成CuSO4溶液,导线中不会有电子流动 | |
| D. | 电路中电子的流动方向是Cu→Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
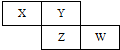 X、Y、Z、W四种短周期元素在周期表中的位置关系如图
X、Y、Z、W四种短周期元素在周期表中的位置关系如图 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
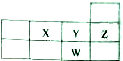
| A. | 原子半径大小:W>Y>X | B. | 核电荷数:W>Z>Y>X | ||
| C. | W的氧化物对应的水化物为强酸 | D. | X是ⅥA族元素,其最高化合价为+6价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com