
【题目】0.2mol某烷烃完全燃烧后,生成的气体缓缓通过盛有0.5L 2mol / LNaOH溶液中,生成的 Na2CO3和NaHCO3的物质的量之比为1:3,则该烷烃为
A. 甲烷 B. 乙烷 C. 丙烷 D. 丁烷
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】热稳定系数和总氯量是漂白粉行业标准里的两个指标。
Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。
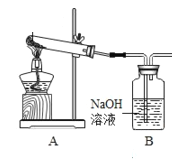
(1)加热干燥漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有________。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。
①B中发生反应的离子方程式为_______。
②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案:_________。
Ⅱ. 测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。
②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000mol/L AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液平均体积为25.00 mL。(已知:Ksp(AgCl,白色)=1.56×10-10,Ksp(Ag2Cr2O4,砖红色)=9.0×10-12)
(3)步骤①中,溶解、稀释的过程所用的玻璃仪器有烧杯、玻璃棒、____、 ____。
(4)加入H2O2水溶液,搅拌至不再产生气泡,目的是______(用离子方程式表示)。
(5)滴定终点的现象是_______。
(6)该漂白粉总氯的百分含量为__________。
(7)下列操作导致总氯百分含量测定结果偏高的是______。
A.指示剂K2CrO4的用量过多
B.在滴定终点读取滴定管刻度时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑ + H2O
B. CaO+H2O=Ca(OH)2
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO 2(g)+O2(g)![]() 2SO3(g);△H=-190KJ·mol-1
2SO3(g);△H=-190KJ·mol-1
(1)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO38g,则V(O2)= mol·L-1·min-1,计算此时化学平衡常数K1= 。
(2)若温度不变,继续通入0.20mol SO2和0.10mol SO3,则平衡移动方向及原因是 ,达平衡后,化学平衡常数为K2,则K1、K2之间的关系为 (填 “>”、“<”或“=”)。
(3)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入体积比为2∶1的等量的SO2和O2,使之发生反应。则(填>、=、<;左、右;增大、减小、不变)。
①达到平衡所需要的时间:t(A) t(B)
②平衡时,SO2的转化率:a(A) a(B)
③达到平衡时,在两容器中分别通入等量的Ar气。B中的化学平衡向 反应方向移动,A中的化学反应速率 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )
A.浓硫酸的体积增大
B.铝的表面生成致密的薄膜
C.澄清的石灰水变浑浊
D.氢氧化钠的表面发生潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是
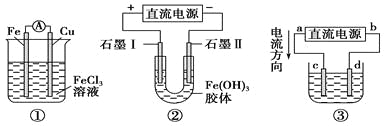
A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2N2(g)+6H2O(g)![]() 4NH3(g)+3O2(g) △H=+Q kJ·mol,下图为该反应在不同初始浓度的N2和不同催化剂I、Ⅱ作用下(其他条 件相同),体积为2L的密闭容器中n(NH3)随反应时间的变化曲线,下列说法正确的是
4NH3(g)+3O2(g) △H=+Q kJ·mol,下图为该反应在不同初始浓度的N2和不同催化剂I、Ⅱ作用下(其他条 件相同),体积为2L的密闭容器中n(NH3)随反应时间的变化曲线,下列说法正确的是

A. 0~6h内,催化剂I的催化效果比催化剂Ⅱ的好
B. a点时,催化剂I、Ⅱ作用下N2的转化率相等
C. 0~5h内,在催化剂I的作用下,O2的反应速率为0.12mol/(L·h)
D. 0~12h内,催化剂Ⅱ作用下反应吸收的热量比催化剂I的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人体重要的营养物质。下列有关的叙述正确的是 ( )
A. 葡萄糖是一种碳水化合物,可以被浓硫酸吸水炭化
B. 葡萄糖是一种已糖
C. 葡萄糖经过水解才能被人体吸收
D. 葡萄糖是所有单糖中最简单的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com