
| A. | 反应中有3molH2C2O4被还原,转移6mol电子 | |
| B. | KClO3发生了还原反应 | |
| C. | KClO3的还原性强于CO2的还原性 | |
| D. | ClO2作水处理剂时,利用了其强氧化性 |
分析 2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O中,Cl元素的化合价由+5价降低为+4价,则KClO3为氧化剂被还原,C元素的化合价由+3加升高为+4价,则H2C2O4为还原剂被氧化,以此来解答.
解答 解:A.C元素的化合价由+3加升高为+4价,则反应中有3molH2C2O4被还原,转移3mol×2×1=6mol电子,故A正确;
B.Cl元素的化合价由+5价降低为+4价,则KClO3为氧化剂被还原发生还原反应,故B正确;
C.由氧化剂的氧化性大于氧化产物的氧化性可知,KClO3的氧化性强于CO2的氧化性,故C错误;
D.由于ClO2中Cl元素的化合价为+4价,所以ClO2作水处理剂时,杀菌消毒效率高利用了其强氧化性,故D正确;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题

| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1 mol O2的同时产生44.8 L H2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
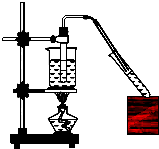 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:A>B>C>D | B. | 单质熔点:D>B,A>C | ||
| C. | 原子半径:C>B>D>A | D. | 简单离子半径:C>A>D>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V3>V2>V1 | B. | V3=V2>V1 | C. | V3>V2=V1 | D. | V1=V2>V3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液使紫色石蕊试液变蓝;结论:溶液一定呈碱性 | |
| B. | 无色溶液焰色反应呈紫色(透过蓝色钴玻璃观察),结论:溶液中一定含有K+ | |
| C. | 在无色溶液中加入Na2CO3溶液产生白色沉淀;结论:溶液中一定含有Ca2+ | |
| D. | 在无色盐溶液中加入NaOH溶液,加热产生的气体使湿润的红色石蕊试纸变蓝;结论:溶液一定含有NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com