
 Si+2CO↑
Si+2CO↑ Si+2CO↑
Si+2CO↑

科目:高中化学 来源:不详 题型:填空题
| 族 周期 | ⅠA | | | | 0 | ||||
| 1 | H | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | | |
| 2 | | | | | | ① | ② | F | Ne |
| 3 | ③ | Mg | | ④ | Si | ⑤ | | ⑥ | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.其单质常温下跟水反应不如钠剧烈 | B.其原子半径比钾原子半径小 |
| C.其碳酸盐易溶于水 | D.其氢氧化物不能使氢氧化铝溶解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.如果电子云图象是由两个s电子重叠形成的,即形成s--sσ键 |
| B.s电子与p电子形成s--pσ键 |
| C.p和p不能形成σ键 |
| D.HCl分子里含有一个s--pσ键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.道尔顿——电子轨道理论 | B.卢瑟福——量子力学模型 |
| C.玻尔——行星绕太阳模型 | D.汤姆逊——葡萄干面包模型 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①>②>③>④ | B.③>④>①>② | C.③>①>②>④ | D.①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 间白色沉淀变为灰绿色,最终变为红褐色;
间白色沉淀变为灰绿色,最终变为红褐色;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 学原理相
学原理相 同
同 s多4个
s多4个 质子
质子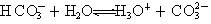
 的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
的非金属性逐渐减弱,故氢卤酸的酸性依次减弱 2NH3
2NH3 (g) △H=-38.6kJ·mol-1
(g) △H=-38.6kJ·mol-1| A.全部 | B.④⑤ | C.②③④⑦ | D.②④⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com