
| A. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- | |
| B. | 有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- | |
| C. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| D. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、K+、AlO2-、SO42- |
分析 A.pH=1的溶液,显酸性,离子之间发生氧化还原反应;
B.离子之间结合生成沉淀;
C.离子之间发生氧化还原反应;
D.c(H+)=1.0×10-13mol•L-1的溶液,显碱性.
解答 解:A.pH=1的溶液呈酸性,ClO-与氢离子反应生成弱酸,H+、ClO-、Cl-发生氧化还原反应,不能大量共存,故A错误;
B.Ba2+与SO42-反应生成沉淀而不能大量共存,故B错误;
C.有NO3-存在的强酸性溶液具有强氧化性,具有还原性的Fe2+、Br-不能大量共存,故C错误;
D.c(H+)=1.0×10-13mol/L的溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
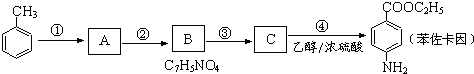
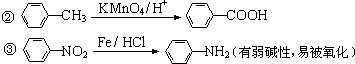
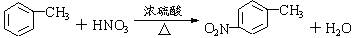 .
.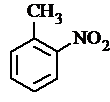 、
、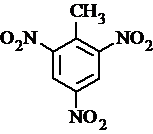 等
等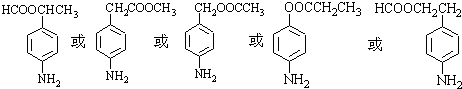 .
.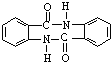 有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下:
有较好的阻燃性,请写出以甲苯为主要原料制备该阻燃剂的合成路线流程图.提示:①合成过程中无机试剂任选;②合成路线流程图示例如下: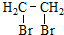
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯中固体有铁、无铜 | B. | 烧杯中固体有铜、无铁 | ||
| C. | 烧杯中固体铁、铜都有 | D. | 烧杯中固体铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
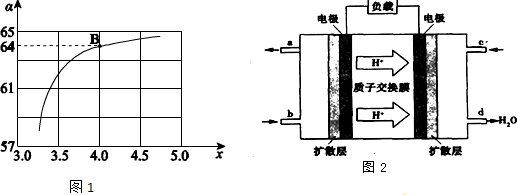
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Fe(OH)3(胶体)+3H+.
Fe(OH)3(胶体)+3H+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com