
【题目】甲醇是最基本的有机化工原料之一。工业上可用二氧化碳和氢气反应来生产甲醇。
(1)已知气态甲醇的燃烧热为a kJ/mol,2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;H2O(g)=H2O(l) ΔH= -ckJ/mol。 则CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的ΔH=_________。
CH3OH(g)+H2O(g)的ΔH=_________。
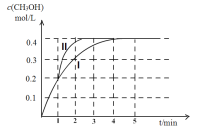
(2)某温度下,在2 L密闭容器中,充入2.4 mol CO2和4.4 mol H2,发生合成甲醇的反应,测得甲醇的物质的量随时间的变化图像如下图中的曲线I,则前4分钟ν(CO2)=__________;若在1 min时,改变某一反应条件,曲线I变为曲线II,则改变的条件为___________;该温度下反应的化学平衡常数为___________。
(3)在恒压的条件下,下列选项能说明CO2+3H2![]() CH3OH+H2O反应已达平衡状态的是______。
CH3OH+H2O反应已达平衡状态的是______。
A、ν正(H2): ν逆(CH3OH)=3:1
B、混合气体的密度不再变化
C、混合气的平均摩尔质量不再变化
D、反应中H2O与CH3OH的物质的量浓度之比为1:1,且比值保持不变
(4)在另一温度下发生合成甲醇的反应,关闭K,向A容器中充入1 mol CO2和4 mol H2,向B容器中充入1.2 mol CO2和4.8 mol H2,两容器分别发生上述反应。已知起始时容器A和B的体积均为a L,反应达到平衡时容器B的体积为0.9a L,维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为______L(不考虑温度的变化,P为可自由滑动活塞,不考虑活塞的摩擦力)。
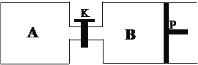
(5)一定条件下甲醇可进一步氧化转化为甲酸。室温下,将amol/L的甲酸与bmol/L的NaOH溶液等体积混合,体系中存在c(Na+)=c(HCOO-),试用含a和b的代数式表示甲酸的电离常数为__________
【答案】(a-1.5b-3c )kJ/mol 0.1 mol·L-1·min-1 加入催化剂 0.2 ABC 0.65a b·10-7/(a-b)
【解析】
(1) ①CH3OH(g) +3/2O2(g)= CO2(g) + 2H2O(l) ΔH=-a kJ/mol;②2H2(g)+O2(g)= 2H2O(g) ΔH=-bkJ/mol;③H2O(g)=H2O(l) ΔH= -ckJ/mol。根据盖斯定律可知:3/2×②+3×③-①可得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= (a-1.5b-3c) kJ/mol;综上所述,本题正确答案是:(a-1.5b-3c )kJ/mol。
CH3OH(g)+H2O(g) ΔH= (a-1.5b-3c) kJ/mol;综上所述,本题正确答案是:(a-1.5b-3c )kJ/mol。
(2)根据图像可知,前4分钟时间内,甲醇的浓度变化了0.4mol/L,ν(CH3OH)=0.4/4=0.1 mol·L-1·min-1 ,根据速率之比和系数成正比规律可知,ν(CO2)= ν(CH3OH)= 0.1 mol·L-1·min-1;若在1 min时,反应达平衡的时间缩短,速率加快,同时甲醇的浓度不变,平衡不动,因此曲线I变为曲线II,则改变的条件为加入催化剂;根据图像可知:CH3OH的物质的量变化了0.4×2=0.8 mol;反应达平衡时,c(CO2)=(2.4-0.8)/2=0.8 mol/L ,(CH3OH )=0.4mol/L ,c(H2)=(4.4-2.4)/2=1 mol/L ,c(H2O )=0.4mol/L;该温度下反应的化学平衡常数为K= c(CH3OH ) c(H2O )/ c(CO2) c3(H2)= 0.4×0.4/0.8×13=0.2;综上所述,本题答案是:0.1 mol·L-1·min-1 ;加入催化剂, 0.2。
(3)在恒压的条件下,下列选项能说明CO2+3H2![]() CH3OH+H2O反应已达平衡状态的是A、ν正(H2): ν逆(CH3OH)=3:1,既标明了正逆反应速率方向,同时又满足速率之比和系数成正比,能够说明反应已达平衡状态,正确;
CH3OH+H2O反应已达平衡状态的是A、ν正(H2): ν逆(CH3OH)=3:1,既标明了正逆反应速率方向,同时又满足速率之比和系数成正比,能够说明反应已达平衡状态,正确;
B、反应前后混合气体的质量不变,反应前后混合气体的体积发生变化,因此当混合气体的密度不再变化时,反应达到平衡状态,正确;
C、反应前后混合气体的质量不变,反应前后混合气体的总量发生变化,因此当混合气的平均摩尔质量不再变化时,反应达到平衡状态,正确;
D、反应中H2O与CH3OH均为生成物,任何时候二者的量之比都为为1:1,不能判断反应达到平衡状态,错误;
综上所述,本题选ABC。
(4)打开K时,AB组成一个等温等压容器,相应的起始投入总物质的量与平衡的总体积成正比,设打开K重新达到平衡后总的体积为x,则x:(5+6)= 0.9a:6,x=1.65 a L;因为起始时容器A的体积为a L,所以重新达到平衡,容器B的体积为1.65a-a=0.65a L;综上所述,本题答案是:0.65a。
(5)根据电荷守恒可知:c(Na+)+ c(H+)=c(HCOO-)+ c(OH-),因为c(Na+)=c(HCOO-),所以溶液呈中性,c(H+)= c(OH-)=10-7mol/L;c(Na+)= c(HCOO-)= b/2mol/L,溶液中剩余的甲酸分子浓度为(a/2-b/2)mol/L,所以甲酸的电离常数=c(H+)×c(HCOO-)/c(HCOOH)= 10-7×b/2/(a/2- b/2)= b·10-7/(a-b) ;综上所述,本题答案是:b·10-7/(a-b)。


科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如下图所示,回答下列问题。
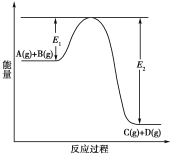
(1)该反应是________反应(填“吸热”或“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”)
(3)反应体系中加入催化剂对反应热是否有影响?___________________________________(填“有”、或“无”)
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,欲使CH3COONa溶液中c(CH3COO-)/c(Na+)的比值增大,可在溶液中加入下列物质中正确的是①固体NaOH ②固体KOH ③固体NaHS ④固体CH3COONa ⑤冰醋酸 ⑥加水
A. ②③④⑤ B. ②④⑤ C. ②⑤⑥ D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒽(![]() )与苯炔(
)与苯炔(![]() )反应生成化合物X(立体对称图形),如图所示:
)反应生成化合物X(立体对称图形),如图所示:
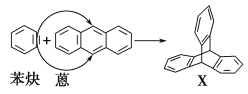
(1)蒽与X都属于________(填选项,下同)。
a.环烃 b.烷烃 c.芳香烃
(2)苯炔的分子式为________,苯炔不具有的性质是________。
a.能溶于水 b.能发生氧化反应
c.能发生加成反应 d.常温常压下为气体
(3)苯是最简单的芳香烃,能证明其化学键不是单双键交替排列的事实是________。
a.它的对位二元取代物只有一种
b.它的邻位二元取代物只有一种
c.分子中所有碳碳键的键长均相等
d.能发生取代反应和加成反应
(4)下列属于苯的同系物的是 (______)。
A.![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
(5)能发生加成反应,也能发生取代反应,同时能使溴水因反应而褪色,也能使酸性高锰酸钾溶液褪色的是(______)。
A. ![]() B.C6H14 C.
B.C6H14 C. ![]() D.
D. ![]()
它是生产某塑料的单体,写出合成该塑料的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A部分:由锆英砂(ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)制备ZrO2的流程如下:

已知:①ZrO2在强碱性溶液中以ZrO32-形式存在,在强酸性溶液中以ZrO2+形式存在。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
Mn+ | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.8 | 5.6 | 8.0 |
(1)操作I所需要的玻璃仪器为___________,操作I除了得到溶液a还可得到_________。
(2)加氨水至溶液a中调节pH的的范围是________________。
(3)操作II会得到滤液b和滤渣II,滤渣II分离过程如下:
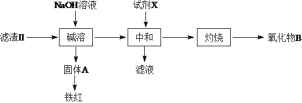
氧化物B的化学式为__________。若试剂X为盐酸,缺点是___________。
(4)操作III除得到Zr(OH)4外还得到某种溶液,向该溶液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为_____________________________。
(5)加入氨水至溶液b发生的离子方程式为__________________________。
(6)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
B部分:钛精矿是从钛铁矿或钛磁铁矿中采选出来,主要成分为FeTiO3,是生产用途非常广泛的钛白粉的原料。以钛精矿石为原料制备金属钛的流程如下图所示(某些过滤过程已忽略)。已知强酸性溶液中,+4价的钛元素以TiO2+形式存在,金属钛不溶于稀非氧化性酸。回答下列问题:

(1)步骤②中加入铁屑的作用是__________________。
(2)晶体K俗称绿矾,晶体K的化学式为____________。
(3)试写出溶液C加热制备钛酸沉淀的化学方程式__________________________________。
(4)步骤⑥加入过量的活性炭,则发生的化学方程式为_______________,已知TiO2+2Cl2![]() TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
TiCl4+O2为吸热反应,且该条件下反应也能够发生,为何制备TiCl4过程中还要加入活性炭,试解释原因_________________。
(5)气体F为氩气,F的作用是_____________________。
(6)溶液H是_________,作用为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的能量变化示意图如下,有关说法正确的是( )
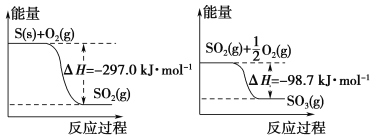
A. 1 mol S(g)与O2(g)完全反应生成SO2(g),反应放出的热量小于297.0 kJ
B. 在相同条件下,SO2(g)比SO3(g)稳定
C. S(s)与O2(g)反应生成SO3(g)的热化学方程式S(s)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=+395.7 kJ·mol-1
SO3(g) ΔH=+395.7 kJ·mol-1
D. 一定条件下1 mol SO2(g)和![]() mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
mol O2(g)反应,生成1 mol SO3(l)放出热量大于98.7 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚醋酸乙烯酯是黏合剂,应用广泛。下面是该有机物的合成路线:
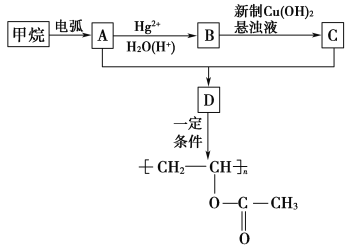
提示:①甲烷在电弧的作用下生成炔烃。
②CH3C≡CH![]() CH3CH2CHO(未配平)。
CH3CH2CHO(未配平)。
请回答下列问题:
(1)甲烷合成A的化学反应中原子利用率为________。
(2)B的结构简式为________。
(3)B生成C的反应中除新制Cu(OH)2悬浊液外还需要的条件是________。
(4)A与C反应生成D的反应类型是________。
(5)写出由D生成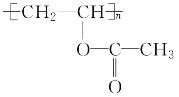 反应的化学方程式:________________________________。
反应的化学方程式:________________________________。
(6)写出能使紫色石蕊溶液变红的D的三种同分异构体的结构简式:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com