
【题目】钼和钒在炼钢、有机化工、高科技等领域有广泛应用。一种从炼油工业的废催化剂(主要成分为V2O5、MoO3、Al2O3、硫化物和碳氢化合物)中回收钼、钒的工艺流程如图:
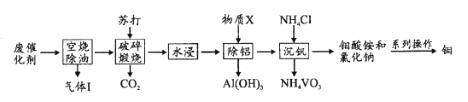
(1)“气体”除CO2、H2O外,还含有的主要成分是____。
(2)“破碎”的目的是____;缎烧中V2O5转化的化学方程式是____。
(3)加人物质X的目的是调节溶液pH除铝,X的化学式是____。
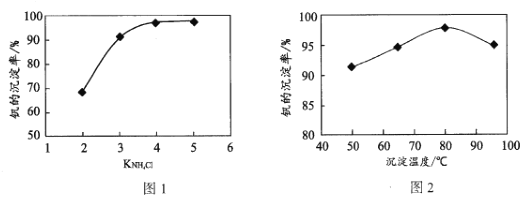
(4)“沉钒”过程中控制pH为8.35,其他条件一定时,钒的沉淀率与加铵系数KNH4Cl、温度的关系分别如图1、图2,则应选择的加铵系数是____;温度超过80°C时,钒的沉淀率下降的原因是____。
(5)钼酸铵[(NH4)2MoO4]在高温下通入H2可制得单质钼,该过程的化学方程式是____。
【答案】SO2(或SO2、SO3) 增大接触面积,加快反应速率 V2O5+Na2CO3![]() 2NaVO3+CO2↑ HCl 4 温度过高,加剧氨挥发,NH4+的浓度下降,沉淀率降低 (NH4)2MoO4+3H2
2NaVO3+CO2↑ HCl 4 温度过高,加剧氨挥发,NH4+的浓度下降,沉淀率降低 (NH4)2MoO4+3H2![]() 2NH3↑+Mo+4H2O或者(NH4)2MoO4
2NH3↑+Mo+4H2O或者(NH4)2MoO4![]() 2NH3↑+MoO3+H2O、MoO3+3H2
2NH3↑+MoO3+H2O、MoO3+3H2![]() Mo+3H2O
Mo+3H2O
【解析】
废催化剂的主要成分为V2O5、MoO3、Al2O3、硫化物和碳氢化合物,空烧时“气体Ⅰ”除CO2、H2O外,还含有SO2,粉碎固体可增大接触面积,加快反应速率,煅烧时发生V2O5+Na2CO3![]() 2NaVO3+CO2↑、MoO3+Na2CO3
2NaVO3+CO2↑、MoO3+Na2CO3![]() Na2MoO4+CO2↑、Al2O3+Na2CO3
Na2MoO4+CO2↑、Al2O3+Na2CO3![]() 2NaAlO2+CO2↑,水浸后加入物质X的目的是调节溶液pH除铝,由后续反应生成NaCl,可知X为HCl,然后加氯化铵沉钒,过滤分离出钒酸铵,从滤液中分离出钼酸铵,在高温下通入H2可制得单质钼,以此来解答。
2NaAlO2+CO2↑,水浸后加入物质X的目的是调节溶液pH除铝,由后续反应生成NaCl,可知X为HCl,然后加氯化铵沉钒,过滤分离出钒酸铵,从滤液中分离出钼酸铵,在高温下通入H2可制得单质钼,以此来解答。
(1)硫化物和碳氢化合物可燃烧,则气体Ⅰ除CO2、H2O外,还含有的主要成分是SO2(或SO2、SO3);
(2)破碎的目的是增大接触面积,加快反应速率;煅烧中V2O5转化的化学方程式是V2O5+Na2CO3![]() 2NaVO3+CO2↑;
2NaVO3+CO2↑;
故答案为:增大接触面积,加快反应速率;V2O5+Na2CO3![]() 2NaVO3+CO2↑;
2NaVO3+CO2↑;
(3)加入物质X的目的是调节溶液pH除铝,X的化学式是HCl,但HCl应适量,不能过量;
故答案为:HCl;
(4)“沉钒”过程中控制pH为8.35,其他条件一定时,由钒的沉淀率与加铵系数KNH4Cl、温度的关系图可知,则应选择的加铵系数是4;温度超过80℃时,钒的沉淀率下降的原因是温度过高,加剧氨挥发,铵根离子浓度下降,沉淀率降低;
故答案为:4;温度过高,加剧氨挥发,铵根离子浓度下降,沉淀率降低;
(5)钼酸铵[(NH4)2MoO4]在高温下通入H2可制得单质钼,该过程的化学方程式是(NH4)2MoO4+3H2![]() 2NH3↑+Mo+4H2O或者(NH4)2MoO4
2NH3↑+Mo+4H2O或者(NH4)2MoO4![]() 2NH3↑+MoO3+H2O、MoO3+3H2
2NH3↑+MoO3+H2O、MoO3+3H2![]() Mo+3H
Mo+3H


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】计算填写下列内容:
(1)2.5molH2SO4的质量是___;
(2)H3PO4的摩尔质量为___;
(3)等质量的氧气和臭氧,他们原子的个数之比为___;
(4)6.02×1023个N2所含___mol质子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。
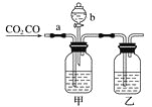
(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
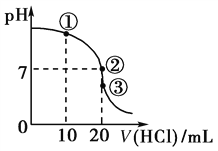
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HA的电离常数Ka=1×10-6,向20 mL浓度为0.01 mol·L-1的HA溶液中逐滴加入0.01mol·L-1的NaOH溶液,溶液的pH与加入NaOH溶液的体积之间的关系如图所示,下列说法正确的是( )
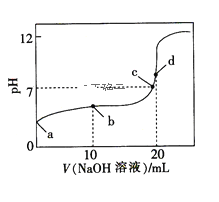
A.a点对应溶液的pH约为4,且溶液中只存在HA的电离平衡
B.b点对应溶液中:c(Na+)>c(A-)>c(HA)>c(H+)>c(OH-)
C.d点对应溶液中:c(OH-)-c(H+)=c(A-)
D.a、b、c、d四点对应的溶液中水的电离程度:a<b<c<d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-![]() ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
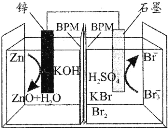
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。
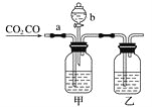
(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次递增,其中Y与Z同主族。X与Y、Z与W均可形成如图所示的分子结构,且Z与W形成的分子中所有原子最外层均满足8电子稳定结构。下列说法中正确的是( )
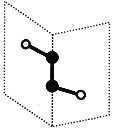
A.离子半径:W>Z>Y>X
B.ZY2和WY2都可以使品红溶液褪色但褪色原理不同
C.氧化物对应的水化物的酸性:W>Z
D.X2Y2,Z2W2均含有非极性共价键且各原子都满足8电子的稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.等体积的CO2和CO,分子数目均为NA
B.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12NA
C.标准状况下,22.4L的H2和22.4L的F2混合后,气体分子数为2NA
D.H2O(g)通过足量Na2O2(s)充分反应,固体增重bg时,反应中转移的电子数为bNA/2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com