
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.分析 (1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)反应CO2(g)+CH4(g)?2CO(g)+2H2(g)是个气体体积增大的反应,根据压强对化学平衡的影响作答,由图知道该温度下Y所处条件下平衡时甲烷的转化率列三段式,带入化学平衡常数计算可得;
(3)①根据影响化学平衡的因素进行判断;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③依据二甲醚通入的量计算物质的量,结合电子守恒计算析出铜的质量;
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量,计算1mol二甲醚气体完全燃烧生成稳定的氧化物放出的热量可得燃烧热的热化学方程式.
解答 解:(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC•CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC;
故答案为:加热;
(2)反应CO2(g)+CH4(g)?2CO(g)+2H2(g)是个气体体积增大的反应,压强越大,CH4的转化率越小,由图可知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)>v(逆);
由图知道该温度下Y所处条件下平衡时甲烷的转化率为80%,列三段式:
CO2(g)+CH4(g)?2CO(g)+2H2(g)
c始:0.1 0.1 0 0
c转:0.08 0.08 0.16 0.16
c平:0.02 0.02 0.16 0.16,
其平衡常数K=$\frac{0.1{6}^{2}×0.1{6}^{2}}{0.02×0.02}$=1.6;
故答案为:小于;大于; 1.6;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故B正确;
C.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故C错误;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:BD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O;
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③以1.12L•min-l(标况)的速率向该电池中通入二甲醚,用该电池电解50mL 2mol•L-1 CuSO4溶液,通电0.50min后,通入二甲醚物质的量1.12L•min-l×0.5min×22.4L/mol═0.025mol;依据电极反应电子守恒,CH3OCH3--12e---6Cu2+,则n(Cu2+)=0.025mol×6=0.15mol,但溶液中的n(Cu2+)只有0.05mL×2mol•L-1=0.1mol,说明铜离子完全参与放电,溶液中水也参与放电,则铜离子全部析出,金属铜的质量为0.1mol×
64g/mol=6.4g;
故答案为:6.4g;
(4)l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ,则l mol二甲醚气体完全燃烧生成稳定的氧化物放出的热量为46g×31.63kJ=1454.98 kJ,则二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol;
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
点评 本题考查了化学平衡的调控作用、化学平衡的影响因素、原电池工作原理及电极反应的书写、化学平衡常数的计算、化学平衡状态的判断等知识,题目难度较大,考查的知识点较大,充分考查了学生对化学平衡、原电池工作原理等知识的掌握情况,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在配制一定物质的量浓度溶液的实验中量筒是必需仪器 | |
| B. | 实验室中,盛装NaOH 溶液的试剂瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则该未知液中不含NH4+ | |
| D. | 用pH试纸测定某溶液的pH时,需预先用蒸馏水湿润pH 试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
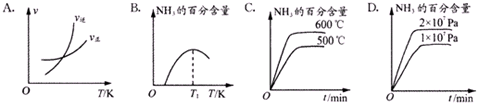
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
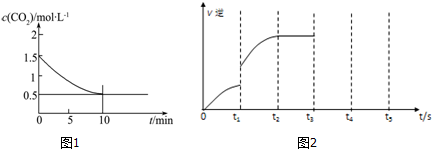
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ③④⑤ | C. | ①②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②③⑤⑨ | C. | ④⑤⑥⑦ | D. | ②③⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,20gH218O中含有中子数目为12NA | |
| B. | 标准状况下,11.2LC2H6中含有极性键的数目为3.5NA | |
| C. | 1LpH=3的CH3COOH溶液中,含有H+的数目大于10-3NA | |
| D. | 1L1mol•L-1稀硝酸(还原产物为NO)与铁完全反应,转移电子数目为0.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com