
【题目】(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa、25℃时,16 gN2H4在氧气中完全燃烧生成氮气,放出热量312 kJ。N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。负极的电极反应方程式是 。
(3)下图是一个电化学过程示意图。

① 锌片上发生的电极反应方程式是 。
② 假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
(5)将0.3 mol AgNO3、0.4 mol Cu(NO3)2和0.1mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,当阴极生成0.1mol气体时,此时,另一极上的气体体积(标准状况)为 。
【答案】(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-624KJ/mol;
(2)O2+2H2O+4e-=4OH-;N2H4+4OH—-4e-=N2+4H2O;
(3)①Cu2++2e-=Cu;②112;(4)2NH3+ClO-=N2H4+Cl-+H2O (5) 6.72L
【解析】
试题分析:(1)16gN2H4的物质的量是0.5mol,所以1molN2H4完全燃烧生成氮气和液态水放出的热量是624kJ,则N2H4完全燃烧反应的热化学方程式是N2H4(1)+O2(g)=N2(g)+2H2O(l) △H=-624.0kJ/mol;
(2)燃料电池中正极发生还原反应,元素的化合价降低,所以是氧气发生还原反应,结合电解质溶液,正极反应的电极反应式为O2+4e-+2H2O=4OH-;负极则是燃料发生反应,根据(1)判断N2H4的氧化产物是氮气,所以负极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(3)①该装置是电解池装置,Zn是阴极,发生还原反应,所以是铜离子得电子发生还原反应,电极反应式为Cu2++2e-=Cu;
②铜片作阳极,发生氧化反应,所以Cu片逐渐溶解,质量减少128g,即Cu的物质的量减少2mol,失去电子4mol,根据整个过程满足得失电子守恒规律,所以氧气得电子的物质的量也是4mol,根据O2 +4e-+2H2O=4OH-可知需要氧气得物质的量是1mol,标准状况下的体积是22.4L,空气中氧气体积含量为20%,所以需要空气的体积是22.4L/20%=112L;
(4)NaClO氧化NH3,制得肼的稀溶液,则Cl元素被还原为氯离子,根据元素守恒,产物中还有水生成,离子方程式为ClO-+2NH3=N2H4+Cl-+H2O。
(5)Ag+和Cl-反应生成AgCl沉淀,反应后溶液中存在0.4molCu2+、0.1molK+、0.2molAg+、1.1molNO3-,阴极生成0.1mol气体,这说明溶液中的铜离子和银离子完全放电,然后是氢离子放电,则转移电子是0.4mol×2+0.2mol+0.1mol×2=1.2mol,则根据阳极反应4OH--4e-=O2+2H2O可知转移1.2mol电子,生成0.3molO2,则气体的体积为0.3mol×22.4L/mol=6.72L。


科目:高中化学 来源: 题型:
【题目】将1﹣氯丙烷跟NaOH的醇溶液共热,生成的产物再跟溴水反应,得到一种有机物,它的同分异构体有(除它之外)( )
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池的应用极为广泛。利用如下图所示原电池可测量空气中Cl2的含量,其中电解质是Ag+可以自由移动的固体物质,下列分析正确的是
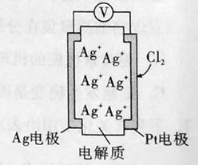
A.电流经外电路从Ag流向Pt电极
B.电池工作时,电解质中Ag+数目增多
C.正极反应:Cl2+2e-=2Cl-
D.空气中c(Cl2)越大,Ag极消耗速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、关于工业转化图(见下图):

1、①反应类型: ④反应类型: 。
2、实验室制备乙烯的反应条件是 ;反应温度过低会产生副产物: (写结构简式);
II、现拟分离混有乙醇、乙酸和水的乙酸乙酯粗产品,下图是分离操作步骤的流程图,试填写图中试剂的化学式及分离方法

(1)试剂b是 ;
(2)分离方法①是: ;分离方法②是: ;
(3)A是: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(反应物和产物中的H2O已略去):
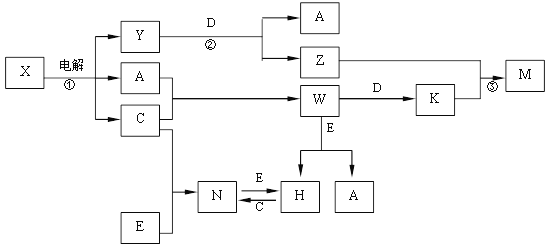
(1)Y的电子式为 ,构成E单质的元素在周期表中位于第 周期第 族
(2)反应①的离子方程式为
反应②的离子方程式为
反应③的离子方程式为
(3)某工厂用C制漂白粉。
①写出制漂白粉的化学方程式
②为测定该工厂制得的漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为:
静置。待完全反应后,用0.1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为 (保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比是化学学习与研究的常用方法。已知:NaH是一种离子化合物,与水反应放出氢气。下列关于铯(Cs)及其化合物的叙述不正确的是( )
A.无水醋酸铯的化学式为CH3COOCs,易溶于水,其水溶液显碱性
B.碳酸氢铯加热即分解生成碳酸铯、二氧化碳和水
C.在Na、K、Rb、Cs中,Cs熔点最高,密度最大
D.CsH是离子化合物,与水反应可以生成H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.漂白粉、液氯、干冰均为混合物 B.16O和18O互为同位素
C.稀硫酸、氨水均为电解质 D.溶于水能电离出H+的物质一定是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.同一物质的固、液、气三种状态的熵值相同
C.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
D.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com