
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 常温下,NH4Cl溶液加水稀释,$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| C. | 0.1 mol•L-1NaCN溶液中含 HCN和CN-总数目为0.1×6.02×1023 | |
| D. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同 |
分析 A.钠与水反应生成氢气,混乱度增大,且放出热量;
B.$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{Kw}{Ka}$;
C.体积未知,不能计算物质的量;
D.不同催化剂对反应的作用不同.
解答 解:A.钠与水反应生成氢气,混乱度增大,且放出热量,△S>0、△H<0,△H-T△S<0,该反应能自发进行,故A正确;
B.温度不变,稀释时$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{Kw}{Ka}$不变,故B错误
C.体积未知,不能计算物质的量,则不能计算HCN和CN-总数目,故C错误;
D.不同催化剂对反应的作用不同,则FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同,故D错误;
故选A.
点评 本题考查反应热与焓变,为高频考点,把握反应进行的方向、Kw与Ka的影响因素、反应速率的影响因素为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
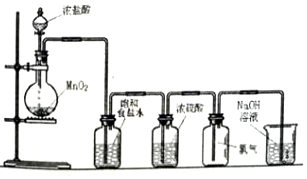
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备: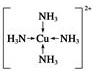 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的简单离子半径比X的简单离子半径大 | |
| B. | 化合物Y2Z中既有离子键、又有共价键 | |
| C. | Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝 | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:HmZ、HnW、HpX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y的单质与其他三种元素的单质都可发生反应 | |
| B. | 由上述四种元素组成的某种化合物的水溶液呈强酸性 | |
| C. | 在Y与Z形成的两种常见化合物中,阴阳离子个数比相同 | |
| D. | 常温下,铁、铝均可与W的最高价含氧酸的浓溶液发生剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v正(A)=v逆(B) | |
| B. | 单位时间内生成a molA,同时生成3a molB | |
| C. | A、B、C的浓度不再变化 | |
| D. | 容器内的总压强不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com