
【题目】苯氧布洛芬钙G是评价较好的解热、镇痛、消炎药,如图是它的一种合成路线(具体反应条件和部分试剂略)

已知:
①氯化亚砜![]() 可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃。
② +X2
+X2 +HX(X表示卤素原子)
+HX(X表示卤素原子)
③![]()
回答下列问题:
(1)F中所含的官能团名称是_______。
(2)![]() 的反应类型是______。
的反应类型是______。
(3)写出F和C在浓硫酸条件下反应的化学方程式______。
(4)写出A的符合以下条件同分异构体的所有结构简式_______。
①属于苯的二取代物; ②苯环上的一氯代物有2种; ③与![]() 溶液发生显色反应。
溶液发生显色反应。
(5)结合上述推断及所学知识,参照上述合成路线任选无机试剂设计合理的方案,以苯甲醇(![]() )为原料合成苯乙酸苯甲酯(
)为原料合成苯乙酸苯甲酯(![]() )写出合成路线,并注明反应条件____。
)写出合成路线,并注明反应条件____。
【答案】醚键、羧基 取代反应 ![]() +
+![]() +H2O
+H2O  、
、

【解析】
根据信息②,A的结构简式为 ,根据苯氧布洛芬钙G的结构简式,A生成B,发生取代反应,即B的结构简式为
,根据苯氧布洛芬钙G的结构简式,A生成B,发生取代反应,即B的结构简式为 ,B转化成C,发生加成反应,即C的结构简式为
,B转化成C,发生加成反应,即C的结构简式为 ,根据信息①,D的结构简式为
,根据信息①,D的结构简式为 ,D生成E,-CN取代-Cl,即E的结构简式为
,D生成E,-CN取代-Cl,即E的结构简式为 ,根据信息③,推出F的结构简式为
,根据信息③,推出F的结构简式为 ,据此分析判断;
,据此分析判断;
(1)根据上述分析,F的结构简式为 ,含有官能团名称为醚键和羧基;
,含有官能团名称为醚键和羧基;
答案为醚键、羧基;
(2)D生成E,-CN取代-Cl的位置,该反应为取代反应;
答案为取代反应;
(3)F和C发生酯化反应,其反应的化学方程式为![]() +
+![]() +H2O;
+H2O;
答案为![]() +
+![]() +H2O;
+H2O;
(4)①属于苯的二取代物,说明苯上有2个取代基,②苯环上一氯代物有2种,说明有2种不同氢原子,可能为对称结构,③与FeCl3发生显色反应,说明含有酚羟基,推知还含有的官能团是碳碳双键和-Br,即符合要求的是 、
、 ;
;
答案为 、
、 ;
;
(5)苯乙酸苯甲酯是由苯乙酸和苯甲醇发生酯化反应生成,苯甲醇与SOCl2发生反应,让-Cl取代反应-OH,然后与NaCN发生反应,让-CN取代-Cl,然后在NaOH、H3O+条件下,-CN转成-COOH,最后发生酯化反应,路线为 ;
;
答案为 。
。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】工业上制汞的过程是:焙烧辰砂(主要含HgS),发生反应:HgS+O2![]() Hg+SO2,还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是( )
Hg+SO2,还原出的汞呈气态,冷凝得液态汞。其流程如图,下列说法不正确的是( )

A. 含汞烟气可以采用活性炭吸附法处理达标后再排放
B. HgS+O2![]() Hg+SO2该反应中HgS只做还原剂
Hg+SO2该反应中HgS只做还原剂
C. 洗涤粗汞时不可用5%的硫酸代替5%的硝酸
D. 流程中加入氧化钙的目的是减少SO2的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表中短周期的一部分,表中所列字母分别代表一种元素。

(1)上述元素的单质中熔点最高的可能是________(填字母);dh4比gh4稳定,其原因是______。
(2)f和a所形成的物质的沸点在f相应主族元素的同类型化合物中比较高,其原因是_____________。
(3)f的氢化物属于___晶体,a与d形成的化合物da4的立体构型是___,它的晶体属于_____晶体。
(4) c、i、j可组成离子化合物cxij6,其晶胞结构如下图所示,阳离子c+(用○表示)位于正方体棱的中点和正方体内部;阴离子ij6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A只由C、H、O三种元素组成,常用作有机合成的中间体,测得8.4g该有机物经燃烧生成22.0g CO2和7.2g水,质谱图表明其相对分子质量为84;红外光谱分析表明A中含有-OH和位于分子端的-C≡C-,核磁共振氢谱显示有3种峰,峰面积之比为6:1:1。
(1)写出A的分子式___________;
(2)写出A的结构简式__________;
(3)下列物质一定能与A发生反应的是_______(填序号)。
A.H2 B.Na C.Br2 D.O2(Cu作催化剂)
解决该题的关键环节为A结构的确定,在解决(2)时,你用到了题干中的哪些谱图信息_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q五种元素,原子序数均小于36,它们的核电荷数依次增加,且核外电子数之和为54。X的激发态原子电子排布式为![]() ,Y原子的基态原子
,Y原子的基态原子![]() 能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
能级上有两个未成对电子,在同周期中Z的基态原子中未成对电子数最多,W的电离能如下表所示,基态Q原子的K层电子数与最外层电子数之比为2∶1,其d轨道处于全充满状态。
元素 | 第一电离能 | 第二电离能 | 第三电离能 |
W | 495.8 | 4562 | 6910.3 |
(1)基态Q原子价电子排布式为_____。
(2)X、Y、Z、Q电负性由大到小排序为___(写元素符号)
(3)X与Z形成的化合物![]() ,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
,Z原子采取的杂化轨道类型为___,Z的最高价氧化物的水化物的正盐的阴离子的空间构型为____;
(4)W的氯化物和![]() 的氧化物中,熔点较高的是____(填化学式),原因是_____。
的氧化物中,熔点较高的是____(填化学式),原因是_____。
(5)由X、Y组成的一种微粒结构如图![]() ,请写出该微粒的化学式:_____。
,请写出该微粒的化学式:_____。
(6)图(a)是![]() 的拉维斯结构,
的拉维斯结构,![]() 以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为
以金刚石方式堆积,半数的四面体空隙中,填入以四面体方式排列的Q。图(b)是沿立方格子对角面取得的截图。设阿伏加德罗常数的值为![]() ,则
,则![]() 的密度是_____
的密度是_____![]() (列出计算表达式)。
(列出计算表达式)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在如图所示的装置里,若灯泡亮,广口瓶内的物质 A 可以是_____(填序号,下同),其中①~⑧中的电解质有_____。
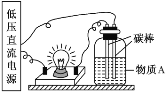
①干燥的氯化钠晶体 ②干燥的氢氧化钠固体 ③蔗糖晶体 ④酒精 ⑤NaHSO4 溶液 ⑥氢氧化钠溶液 ⑦稀盐酸 ⑧Ba(OH)2 溶液
(2)向盛有⑧的溶液中,逐滴加入⑤,当溶液中的Ba2+恰好完全沉淀时,发生反应的离子 方程式为_________。
(3)某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO32-、NO3-。现进行如下实验:
①用红色石蕊试纸检验,试纸变蓝色。
②另取少量溶液逐滴滴加盐酸至过量,无气体放出,再加入 BaCl2 溶液后,没有沉淀生成。
③另取少量溶液用硝酸酸化后,加入 AgNO3 溶液有白色沉淀生成。 根据上述实验推断:原溶液中肯定有__________离子,肯定没有_____离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )

A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中存在多种平衡,请回答下列问题。
(1)有下列几种溶液:a.NH3·H2O b.CH3COONa c.NH4Cl d.NaHSO4常温下呈酸性的有_________(填序号)。
(2)已知25℃ 时,醋酸的Ka=1.8×10-5 ,碳酸的Ka1=4.3×10-7,Ka2=5.6×10-11。有①NaHCO3溶液,②CH3COONa溶液,③NaOH溶液各25 mL,浓度均为0.1mol/L三种溶液的pH由大到小顺序为______________(请序号);已知NaHCO3溶液呈碱性,该溶液中除水的电离外还存在着两个平衡,用电离方程式或离子方程式表示:_________________、_________________,该溶液中的离子浓度由大到小的顺序是: __________________。
(3)有浓度均为0.1 mol/L的 ①盐酸 ②硫酸 ③醋酸三种溶液,(请用序号填空) 三种溶液的pH由大到小的顺序为____________________;中和一定量NaOH溶液生成正盐时,需上述三种酸的体积大小关系为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com