
| A、pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B、pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| C、pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D、pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |


科目:高中化学 来源: 题型:
| A、烧杯中的溶液呈棕黄色 |
| B、铜片无任何变化 |
| C、铜片上有凹陷的“Cu”字 |
| D、发生了反应:Fe3++Cu=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、氧化铁能与酸反应,可用于制作红色涂料 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| 物质 | 酒精 | 浓硫酸 | 汽油 | 氯酸钾 |
| 标签 |  |  |  |  |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入KSCN溶液一定不变红色 |
| B、溶液中一定含Fe2+ |
| C、剩余固体中一定含Cu |
| D、溶液中一定含Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焰色反应是金属单质表现的性质 |
| B、焰色反应为黄色时,不能确定原物质中是否含有钾元素 |
| C、焰色反应是因为发生了化学变化而产生的 |
| D、所有的焰色反应都必须通过蓝色的钴玻璃进行观察 |
查看答案和解析>>
科目:高中化学 来源: 题型:
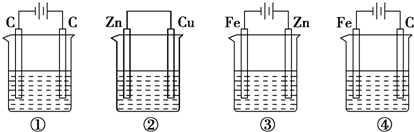
查看答案和解析>>
科目:高中化学 来源: 题型:
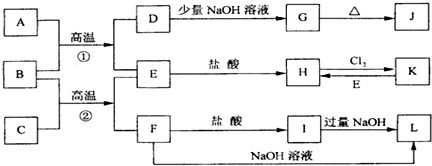
查看答案和解析>>
科目:高中化学 来源: 题型:
| C(NO) | C(CO) | C(CO2) | C(N2) | |
| A | 1 | 1 | 0.1 | 0.1 |
| B | 0.1 | 0.1 | 0.1 | 0.1 |
| C | 0.2 | 0.1 | 0.2 | 1 |
| D | 0.3 | 0.2 | 0.2 | 0.3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com