
| A. | 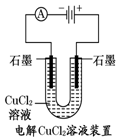 装置中阳极上析出红色固体 | |
| B. | 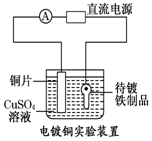 装置的待镀铁制品应与电源正极相连 | |
| C. | 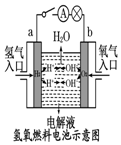 装置中外电路电子由a极流向b极 | |
| D. |  装置的阳极反应为:2H++2e-=H2↑ |
分析 A.阳极上氯离子生成单质生成氯气,阴极铜离子得到电子生成铜;
B.电镀铜时,待镀铁制品作阴极,待镀铁制品应与负极相连;
C.外电路中电子从负极流向正极,通入氢气的一极为负极,通入氧气的电解为正极;
D.电解池中,阳极失去电子发生氧化反应,该反应中应该为氯离子失去电子生成氯气.
解答 解:A.装置中阳极上氯离子失去电子生成氯气,不会析出红色固体,故A错误;
B.在铁制品上镀铜时,阳极为铜,阴极为铁制品,所以铜片应该与电源的正极相连,待镀铁制品应与电源负极相连,故B错误;
C.装置中通入氧气的电解为正极,电子在外电路中从负极流向正极,即:a极→b极,故C正确;
D.阳极发生氧化反应为2Cl--2e-═Cl2↑,阴极才是氢离子得到电子生成氢气,故D错误;
故选C.
点评 本题考查了化学实验方案的评价,题目难度中等,明确原电池、电解池的工作原理为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:填空题
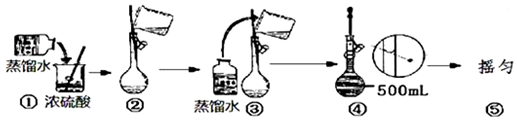
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16bc克 | B. | (a-16bc)克 | C. | (a-32bc)克 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 g 98%的硫酸(密度为1.84 g/cm3)与5 mL 18.4 mol/L硫酸的浓度是不同的 | |
| B. | 制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 含碳的化合物之间很容易发生转化.请回答下列问题:
含碳的化合物之间很容易发生转化.请回答下列问题: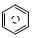 (l)的燃烧热为 3267.5kJ•mol-1,
(l)的燃烧热为 3267.5kJ•mol-1,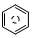 (l)+6O 2(g)═6CO2 (g)+3H2 (g)
(l)+6O 2(g)═6CO2 (g)+3H2 (g)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含nmolNH4Al(SO4)2的溶液中,逐滴加入含nmolNaOH的溶液:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaAlO2溶液中通入足量CO2气体:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向溴水中通入SO2气体:SO2+Br2+2H2O═2H++SO42-+2HBr | |
| D. | 含2nmolNaOH的溶液和含nmolCa(HCO3)2的溶液混合OH-+Ca2++HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压缩容器体积 | B. | 降温 | ||
| C. | 增大C(s)的量 | D. | 恒温恒压时加入一定量H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com