
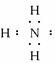
请按要求回答:
(1)写出A的化学式______________,H的电子式______________。
(2)反应⑤进行的条件是______________________________。
(3)将少量的D气体通入足量的NaOH溶液的离子反应方程式为______________________________。
(4)反应③的化学方程式为_______________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
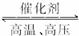
请按要求填空:
(1)写出下列物质的化学式:
A:____________________,E:____________________,
F:____________________,Y:____________________。
(2)反应⑤的化学方程式为_________________________________________________。
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为______________。
查看答案和解析>>
科目:高中化学 来源:2010—2011学年甘肃省天水一中高二下学期期末考试化学试卷 题型:填空题
(6分)请根据题目要求回答下列问题:
(1)工业接触法制硫酸的生产中用到的设备有:①沸腾炉② ,
③吸收塔,写出设备②中,发生的主要反应的化学方程式 。
(2)已知SO2转化为SO3的反应为放热反应,下图中正确的是 (填序号)。
(3)在吸收塔中,为了提高SO3的吸收率,工业上选择的吸收剂是 (填序号)。
| A.H2O | B.稀H2SO4 |
| C.98.3%H2SO4 | D.NH3·H2O溶液 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年广东省佛山市高三5月临考集训理科综合化学试卷(解析版) 题型:填空题
一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍:


则该反应的△H 0(选填“>” 或“<”)。
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
C(s)+O2(g)=CO2(g) △H1=-393.5kJ.mol-1
CO2(g)+C(s)=2CO(g) △H2=+172.5kJ.mol-1
S(s)+O2(g)=SO2(g) △H3=-296.0kJ.mol-1
请写出CO除SO2的热化学方程式 。
 (3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
(3)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数为9.0。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为
,H2的平均生成速率为
。
(4)下图中图1是一种新型燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
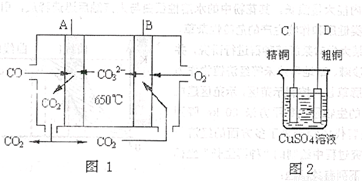
回答下列问题:
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与 极(填“C”或“D”)相连。
③当消耗标准状况下2.24LCO时,C电极的质量变化为 。
查看答案和解析>>
科目:高中化学 来源:2012届辽宁省高二6月月考化学试题 题型:填空题
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。
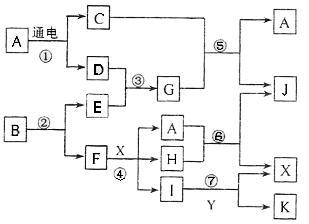
请按要求填空:(1)写出A的电子式 、F元素在周期表位置 (2)反应⑤的化学方程式为: 。
(3)常温下,G和X反应生成Z,写出0.1mol/L Z溶液中离子浓度由大到小的顺序是 。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com