
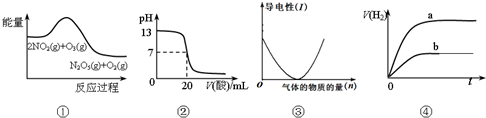
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.1 mol/LCH3COOH溶液滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入醋酸体积的变化 | |
| C. | ③可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
分析 A、反应物的总能量高于生成物的总能量;
B、两者恰好完全反应生成醋酸钠,溶液呈碱性;
C、溶液的导电性与溶液中离子的浓度成正比;
D、体积和pH均相同的HCl和CH3COOH两种溶液中,说明醋的浓度远大于盐酸.
解答 解:A、反应物的总能量高于生成物的总能量,所以正反应是放热反应,△H<0,故A错误;
B、两者恰好完全反应生成醋酸钠,溶液呈碱性,而不是中性,故B错误;
C、醋酸是弱电解质,向醋酸中通入氨气,醋酸和氨气反应生成强电解质醋酸铵,溶液中离子浓度增大,导电性增强,故C错误;
D、体积和pH均相同的HCl和CH3COOH两种溶液中,说明醋的浓度远大于盐酸,所以开始氢离子的浓度相同,随着反应的进行醋酸不停电离氢离子,反应醋酸反应速率快,最终生成氢的量多,故D正确;
故选D.
点评 本题考查了图象分析题,注意分析图象纵横坐标的含义及图象的变化,结合规律来解答问题,中等难度.


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2属于大气污染物 | B. | 酸雨是PH小于7的雨水 | ||
| C. | CO2、NO2或SO2都会导致酸雨的形成 | D. | NO2造成光化学烟雾的主要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于有气体参加的反应,增大压强,反应速率加快,是因为活化分子百分数增加 | |
| B. | 设NA为阿伏加德罗常数的值,500 mL 1mol/L氯化铁溶液中Fe3+的数目等于0.5NA | |
| C. | 常温下将干燥的pH试纸浸泡在0.01mol/L的NaOH溶液中来测溶液的pH,测得pH=12 | |
| D. | 要判断反应进行方向,须综合考虑体系的焓变和熵变,焓减且熵增的反应为自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
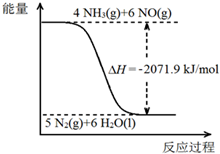 尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.
尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)?2NH3(g)+CO2(g)△H=+133.6kJ/mol.尿素在一定条件下可将氮的氧化物还原为氮气.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
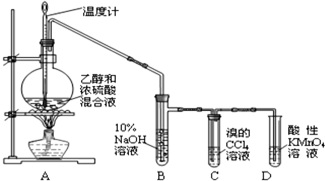
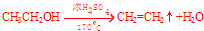 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
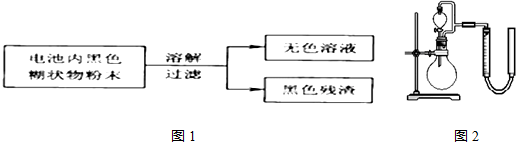
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com