
| A. | 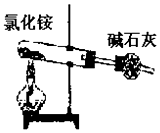 实验室制NH3 | B. | 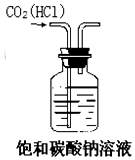 除去CO2中的HCl | ||
| C. |  检验K2CO3的K+ | D. | 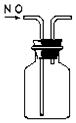 收集NO |
分析 A.制备氨气,应用氯化铵和氢氧化钙在加热条件下进行;
B.二者都与碳酸钠溶液反应;
C.检验钾离子,应透过蓝色钴玻璃;
D.NO易与氧气反应,不能用排空法收集,如用排水法,则NO应从短导管进入.
解答 解:A.氯化铵加热分解生成氨气、氯化氢,二者在温度稍低时又可生成氯化铵,应用氯化铵和氢氧化钙在加热条件下进行,故A错误;
B.二者都与碳酸钠溶液反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C.检验钾离子,应透过蓝色钴玻璃,以滤去黄光,故C正确;
D.NO易与氧气反应,不能用排空法收集,如用排水法,则NO应从短导管进入,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,侧重考查学生的分析能力和实验能力,本题注意把握实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:实验题
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl,加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
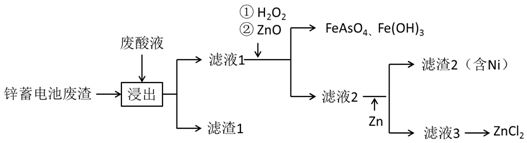
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Cl-、Na+ | B. | MnO4-、Ca2+、NO3-、Cl- | ||
| C. | HSO3-、HCO3-、NO3-、SO32- | D. | Na+、Ca2+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10mL3.4mol•L-1的FeCl3溶液滴入沸水中制成Fe(OH)3胶体,所得体系中胶粒的数目小于0.034NA | |
| B. | 3.6gH2O与19.6g浓硫酸所含分子数均为0.2NA | |
| C. | I7.4g MnO2与40mL 10mol•L-1浓盐酸反应,转移电于的数目为0.2NA | |
| D. | 常温下pH=4的醋酸溶液中由水电离出的H+的数目为10-10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平、烧杯、容量瓶、玻璃棒 | |
| B. | 烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 烧杯、容量瓶、玻璃棒、胶头滴管 | |
| D. | 烧杯、容量瓶、玻璃棒、胶头滴管、量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2分子中所有原子最外层都为8电子结构 | |
| B. | WX2、ZX2是酸性氧化物 | |
| C. | X与Z的氢化物中沸点较高的是Z | |
| D. | WX2中只含有极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com