


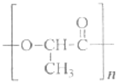
 的结构简式可知,该高分子化合物属于缩聚反应产物;将中括号去掉,分别添上H原子和羟基可得该高分子化合物的单体为CH3CHOHCOOH,
的结构简式可知,该高分子化合物属于缩聚反应产物;将中括号去掉,分别添上H原子和羟基可得该高分子化合物的单体为CH3CHOHCOOH,

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | 303 | 313 | 323 |
| 平衡时NH3的生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
6 3 |
14 7 |
23 11 |
7 3 |
14 6 |
24 12 |
 ⑩
⑩ (11)
(11)
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/s | 0 | 80 | 160 | 240 | 320 |
| c(NO2)/mol?L-1 | 0.0540 | 0.0420 | 0.0340 | 0.0300 | 0.0300 |
| c(N2O4)/mol?L-1 | 0 | 0.0060 | 0.0100 | 0.0120 | 0.0120 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求:
某学生课外兴趣小组为研究某镁铝合金的成分,用天平称取0.51g该合金,溶于100mL盐酸,形成无色溶液,然后逐滴加入1mol?L-1 NaOH溶液,生成沉淀质量随NaOH溶液体积变化如图所示.求:查看答案和解析>>
科目:高中化学 来源: 题型:
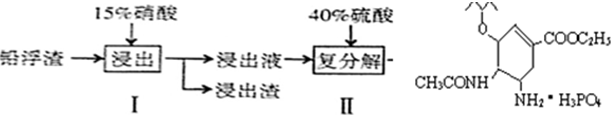
| 化学式 | CaSO4 | Ag2SO4 | PbSO4 |
| Ksp | 4.9×10-5 | 1.2×10-5 | 1.6×10-8 |
| A、步骤I有NO产生,浸出液中含量最多的金属阳离子为Pb2+ |
| B、步骤I需控制硝酸的用量并使Pb稍有剩余,其目的是防止Ag被溶解进入溶液 |
| C、母液可循环利用于步骤I,其溶质主要是Pb(NO3)2 |
| D、产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去CaSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com