
Na2S2O3·5H2O俗称“海波”,是常用的脱氯剂、定影剂和还原剂;它是无色易溶于水的晶体,不溶于乙醇,在20 ℃和70 ℃时的溶解度分别为60.0 g和212 g,Na2S2O3·5H2O于40~45 ℃熔化,48 ℃分解。下面是实验室制备及相关性质实验。
制备海波的反应原理:Na2S O3+S
O3+S Na
Na 2S2O3
2S2O3
制备海波的流程:

(1)实验开始时 用1 mL乙
用1 mL乙 醇润湿硫粉的作用是 。
醇润湿硫粉的作用是 。
A.有利于亚硫酸钠与硫黄的充分接触
B.防止亚硫酸钠溶解
C.控制溶液的pH
D.提高产品的纯度
(2)趁热过滤的原因是 。
(3)滤液不采用直接蒸发结晶的可能原因是  。
。
(4)抽滤过程中需要洗涤产品晶体,下列液体最适合的是 。
A.无水乙醇 B.饱和NaCl溶液
C. 水 D.滤液
水 D.滤液
(5)产品的纯度测定:取所得产品10.0 g,配成500 mL溶液,再从中取出25 mL溶液于锥形瓶中,滴加几滴淀粉作指示剂,然后用0.050 mol·L-1的标准碘水 溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
溶液滴定,重复三次,平均消耗20 mL标准碘水,涉及的滴定化学方程式:
I2+2Na2S2O3 2NaI+Na2S4O6
2NaI+Na2S4O6
产品中的Na2S2O3·5H2O的纯度为 %。
.规范答题:(1)A
(2)防止温度降低而使Na2S2O3晶体析出
(3)直接蒸发结晶易使Na2S2O3·5H2 O熔化、分解
O熔化、分解
(4)A
(5)99.2
解析:(1)S在乙醇中的溶解度大于水中,故实验开始时用1 mL乙醇润湿硫粉有利于亚硫酸钠与硫黄的充分接触;(2)Na2S2O3·5H2O的溶解度在20 ℃和70 ℃时分别为60.0 g和212 g,故趁热过滤可以防止温度降低而使Na2S2O3晶体析出;(3)Na2S2O3·5H2O在40~45 ℃熔化,48 ℃分解,故直接蒸发结晶易使Na2S2O3·5H2O熔化、分解;(4)Na2S2O3·5H2O不溶于乙醇,故选乙醇比较好;(5)Na2S2O3·5H2O的纯度=×100%=99.2%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
向100mL的FeBr2溶液中,通入标准状况下Cl2 5.04L,Cl2全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度是
A.0.75mol/L B.1.5mol/L C.2mol/L D.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是( )
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是 ( ) 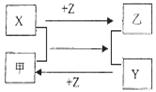
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
海水中含有大量化学物质,是巨大的化学资源宝库,利用海水资源可以获取一系列化 工产品。
工产品。

(1)请写出电解饱和食盐水的化学方程式:  。
。
(2)在 电解饱和食盐水的装置中,阴极产生的气体为 。
电解饱和食盐水的装置中,阴极产生的气体为 。
为了降低能耗,充分利用氯碱工业产品进行联合生产的方法得 到推广应用。
到推广应用。
根据上图,请回答下列问题:
(3)X气体为 (填化学式)。
(4)写出图中燃料电池负极的电极反应: 。
(5)若用浓硫酸处理钛铁矿,并向所得溶液中加入铁,则此时溶液中含有Fe2+、TiO2+和少 量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。
量Mg2+等阳离子。常温下,三种阳离子对应的氢氧化物的溶解度(S/mol·L-1)与溶液pH的关系如图所示。

已知将上述处理液加水稀释后,立即析出大量白色沉淀,请写出该反应的离子方程式: 。
(6)已知:①Mg(s)+Cl2(s) MgCl2(s) ΔH=-641 kJ·mol-1
MgCl2(s) ΔH=-641 kJ·mol-1
②Ti(s)+Cl2(g) TiCl4(l) ΔH=-385 kJ·mol-1
TiCl4(l) ΔH=-385 kJ·mol-1
写出Mg与TiCl4反应的热化学方程式:  ;该反应过程中还应控制的反应条件是 。
;该反应过程中还应控制的反应条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式为C10H20O2的有机物在酸性条件下可水解为醇A和酸B,A经过连续氧化可转化为B,若不考虑立体异构,符合上述要求的醇和酸若重新组合,可形成的酯共有:( )
A.32 B.16 C.8 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺流程提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是________(填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁等的提取工艺
(2)采用“空气吹出法”从浓海水吹出Br2,并用纯碱吸收。溴歧化为Br-和BrO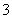 并没有产生CO2则反应的离子反应方程式为 。
并没有产生CO2则反应的离子反应方程式为 。
(3)海水提镁的一段工艺流程如下图:
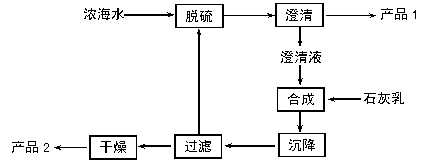 |
浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的阳离子_________,获得产品2的离子反应方程式为 ,浓海水的利用率为90%,则1L浓海水最多可得到产品2的质量为________g。
(4)由MgCl2·6H2O制备MgCl2时,往往在HCl的气体氛围中加热。其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CH3OH(g)+3/2O2(g) = CO2(g) + 2H2O(g) △H = a kJ·mol- 1
CH4(g) + 2O2(g) = CO2(g) + 2H2O(g) △H = b kJ·mol- 1
则下列叙述正确的是
A.C—H键键长小于H—H键
B.甲烷的燃烧热为b kJ·mol -1
C.2CH3OH(g)=2CH4(g)+O2(g) △H=2(a—b) kJ·mol- 1
D.当甲醇和甲烷物质的量之比为l:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为c kJ,则该混合物中甲醇的物质的量为c/(a+2b)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com