
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
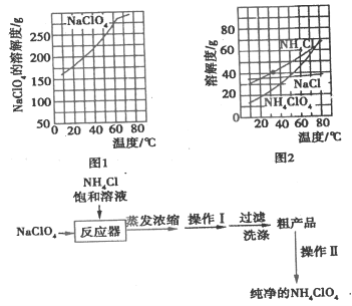
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
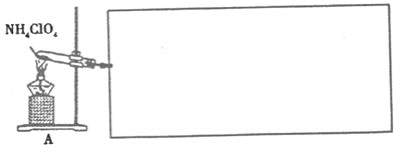
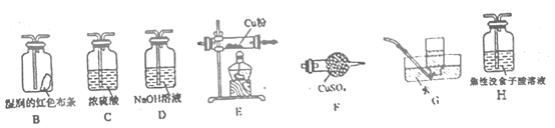
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
【答案】复分解反应 重结晶 0℃冷水 2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】
(1)高氯酸钠与氯化铵反应生成高氯酸铵,化合价未变;
(2)由粗产品获得纯净的高氯酸铵操作属于晶体的提纯;
(3)NH4ClO4的溶解度随温度的升高而增大;
(4)①结合原子个数守恒进行配平;
②用无水CuSO4固体(F)检验H2O(g),再用湿润的红色布条(F)检验Cl2;对O2的检验应用O2将铜氧化的性质,由于Cl2同样具有氧化性,因此需先用NaOH溶液(D)除去Cl2,再通过浓硫酸(C)干燥,气体通过Cu粉(E)检验O2;G装置排水集气法用于检验N2,由于O2也难溶于水,因此需先用焦性没食子酸(H)吸收O2;
③Mg能与N2反应生成Mg3N2,Mg3N2与水反应生成的使湿润的红色石蕊试纸变蓝的气体为NH3。
(1)由流程可知,高氯酸钠与氯化铵反应生成高氯酸铵,则化学方程式为:NaClO4+NH4Cl=NH4ClO4+NaCl,该反应为复分解反应;
(2)由粗产品获得纯净的高氯酸铵操作属于晶体的提纯,而晶体的提纯用重结晶;
(3)由图2可知,NH4ClO4的溶解度随温度的升高而增大,因此洗涤NH4ClO4粗产品时,应选用0℃冷水进行洗涤,防止NH4ClO4溶解损耗;
(4)①由题干可知,NH4ClO4分解产生N2、Cl2和H2O,结合原子个数守恒可得,反应过程中还生成O2,因此该反应的化学方程式为:2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O↑;
N2↑+Cl2↑+2O2↑+4H2O↑;
②对产生气体的检验时,应首先用无水CuSO4固体(F)检验H2O(g),再用湿润的红色布条(F)检验Cl2;对O2的检验应用O2将铜氧化的性质,由于Cl2同样具有氧化性,因此需先用NaOH溶液(D)除去Cl2,再通过浓硫酸(C)干燥,气体通过Cu粉(E)检验O2;G装置排水集气法用于检验N2,由于O2也难溶于水,因此需先用焦性没食子酸(H)吸收O2,因此装置的连接顺序为:A→F→B→D→C→E→H→G;证明O2存在的实验现象为:E中红色粉末变为黑色;
③水反应生成的使湿润的红色石蕊试纸变蓝的气体为NH3,因此反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。


科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.将少量SO2气体通入过量氨水中:SO2+NH3·H2O=NH![]() +HSO
+HSO![]()
B.铝溶于NaOH溶液中:2Al+2OH-+2H2O=2AlO![]() +3H2↑
+3H2↑
C.用醋酸除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.用KIO3氧化酸性溶液中的KI:5I-+IO![]() +3H2O=3I2+6OH-
+3H2O=3I2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是

A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e—===Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e—===H·
C. 鼓入空气时,每生成1mol·OH有2 mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是( )
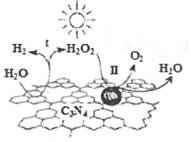
A.C3N4中C的化合价为-4 B.反应的两个阶段转移电子数相等
C.阶段Ⅱ中,H2O2既是氧化剂,又是还原剂 D.通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下其流程图如下:
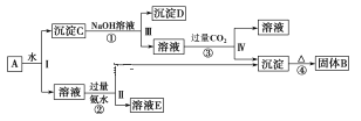
(1)写出下列B、D所含物质的化学式:固体B____; 沉淀D_____。
(2)进行操作Ⅰ、Ⅱ、Ⅲ、Ⅳ所用到的玻璃仪器为___________________;
(3)写出②、③的反应离子方程式:
②_____________________________________________。
③___________________________________________________________________
(4)KAl(SO4)2净水的原因是_____________________________。(用离子方程式和必要的文字解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4.考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
![]()
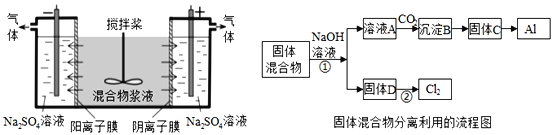
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)C→Al的制备方法称为电解法,请写出阳极反应方程式_____________________.
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2.由此判断影响该反应有效进行的因素有(填序号)_____。
A.温度 B.溶液的pH值 C.Cl-和![]() -的浓度
-的浓度
(3)固体D是碱性锌锰电池的正极,请写出该电池的负极反应方程式_____________ 。
(4)0.2molCl2与焦炭、TiO2完全反应,生成CO和TiCl4(熔点-25℃,沸点136.4℃)放热8.56kJ,该反应的热化学方程式为______________________________________.
Ⅱ.含铬元素溶液的分离和利用
(5)用惰性电极电解时,![]() 能从浆液中分离出来的原因是_________________,
能从浆液中分离出来的原因是_________________,
分离后得到的含铬元素的粒子有![]() ﹣和
﹣和![]() ﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
﹣,原因是__________________________(用离子反应方程式表示),阴极室生成的物质为_____________(写化学式);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车常装有安全气囊,当发生强烈碰撞时,瞬间引发以下反应:2NaN3=2Na+3N2↑,所产生的气体快速充满气囊,可以达到保护车内人员的目的。
①若130gNaN3完全分解,在标准状况下,气囊膨胀的体积约为___。
②该反应中的氧化剂是___,氧化产物是___。
(2)O3能与KI溶液反应,生成一种能使带火星木条复燃的气体,向反应后溶液中滴入酚酞变为红色,若滴入淀粉溶液则变为蓝色。为测定大气中O3的含量,将0℃、1.01×105Pa、33.6m3的空气通入KI溶液,使之完全反应,再向所得溶液中滴加0.01mol/L的Na2S2O3溶液60mL恰好与之完全反应。(I2与Na2S2O3的反应式:2NaS2O3+I2=Na2S4O6+2NaI)
①写出并配平O3与KI溶液反应的化学方程式___;
②计算大气中O3的体积分数(即O3的体积与空气体积的比值,用科学记数法表示)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有相同的电子层结构的四种微粒:aAn+、bB(n+1)+、cCn-、dD(n+1)-,关于A、B、C、D四种元素叙述正确的是
A.一定都是短周期元素
B.原子序数:B > A > C > D
C.单质的还原性:B > A
D.气态氢化物的稳定性:D > C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
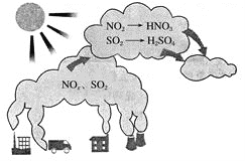
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com