
分析 (1)①根据酸碱中和滴定操作正确的操作步骤进行排序;
②氢氧化钠与硫酸恰好中和溶液的pH为7,据此选择指示剂;
③根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
观察碱式滴定管读数时,若滴定前仰视,则读数偏大,滴定后俯视,则读数偏小;
(3)根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量浓度.
解答 解:(1)①用标准0.14mol/L NaOH溶液滴定硫酸的实验操作步骤为:检查滴定管是否漏水、洗涤滴定管、润洗并盛装标准液、润洗盛装标准液的滴定管、盛装标准液、开始滴定、重复滴定等,所以正确的操作顺序为:ECBADGF;
故答为:ECDBAGF;
②氢氧化钠与硫酸恰好中和溶液的pH为7,可以选用酚酞(变色范围为:8-10)作为指示剂,
故答案为:酚酞;
③滴定结束前,滴入酚酞的硫酸溶液为无色,滴定结束时,溶液变成红色,所以滴定终点现象为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色,
故答案为:滴入最后一滴NaOH溶液,溶液突然变成红色,半分钟不褪色;
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗,相当于标准液被稀释,所以消耗掉的稀硫酸就会增多,滴定结果偏大,
故答案为:偏大;
观察碱式滴定管读数时,若滴定前仰视,则读数偏大,滴定后俯视,则读数偏小,两个读数差即是反应消耗的氢氧化钠的体积,两个读数差偏小,即消耗的氢氧化钠的体积偏小,求出硫酸的物质的量浓度偏小,
故答案为:偏小;
(3)根据反应:2NaOH+H2SO4=Na2SO4+2H2O,稀释后的硫酸溶液浓度为:c(H2SO4)=$\frac{\frac{1}{2}×0.14mol/L×0.015L}{0.025L}$=0.042mol/L,
稀释前稀硫酸的浓度为:0.042mol/L×$\frac{100mL}{1mL}$=4.20mol/L,
故答案为:4.20.
点评 本题考查了酸碱中和滴定实验操作及误差分析,熟记酸碱中和滴定的实验步骤和注意事项,侧重考查学生分析能力和实验能力,题目难度中等.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.75 g | B. | 4.05g | C. | 2.70 g | D. | 1.80 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
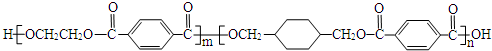
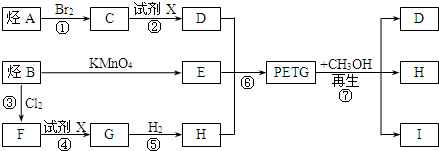
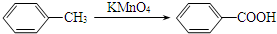
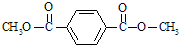 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
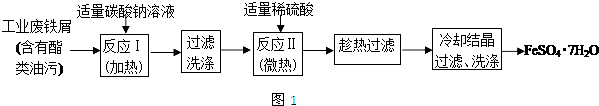

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
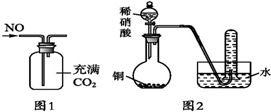
| A. | 汽车尾气中有NOx,主要是汽车打火时氮气和氧气反应引起的 | |
| B. | 可以用图1所示装置收集到干燥的NO气体 | |
| C. | 根据图2装置收集到的气体为无色能够验证铜和稀硝酸反应的产物中气态物质只有NO | |
| D. | 可以用湿润的淀粉碘化钾试纸鉴别红棕色气体NO2和溴蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
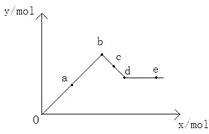
| A. | a-b时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | c-d时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | a-d时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | d-e时溶液中离子的物质的量:Ba2+可能等于OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )
X、Y、Z、W 均为中学化学中常见物质或其溶液,一定条件下它们之间有如下转化关系(其它产物已略去),下列说法不正确的是( )| A. | 若 W 是单质铁,则 Z 溶液可能是 FeCl2 溶液 | |
| B. | 若 X 是碳酸钠,则 W 可能是盐酸 | |
| C. | 若 W 是氢氧化钠,则 X 与 Z 可反应生成 Y | |
| D. | 若 W 为氧气,则 Z 与水反应(或溶于水)一定生成一种强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
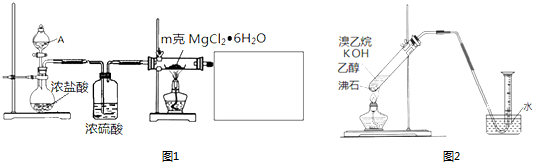
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com