
| A. | Na2CO3能电离出CO32-,可用澄清石灰水鉴别Na2CO3和NaHCO3溶液 | |
| B. | 钠保存在煤油中,是因为煤油不与钠反应,且钠比煤油密度大、煤油可以隔绝空气 | |
| C. | 用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应 | |
| D. | 钠长期暴露在空气中的产物是Na2CO3,原因是钠在空气中生成的Na2O会与水和二氧化碳反应 |
分析 A.Na2CO3溶液和NaHCO3溶液均与石灰水反应生成白色沉淀;
B.钠比煤油密度大,且不反应,钠沉在底部,煤油可以使钠隔绝空气和水蒸气;
C.脱脂棉燃烧需要达到其着火点,应由过氧化钠与二氧化碳、水反应提供热量;
D.钠与氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠潮解,氢氧化钠溶液吸收二氧化碳生成碳酸钠晶体,碳酸钠晶体风化得到碳酸钠.
解答 解:A.Na2CO3溶液和NaHCO3溶液均与石灰水反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.钠与煤油不反应,且比煤油密度大,钠沉在底部,煤油可以使钠隔绝空气和水蒸气,防止钠与氧气、水反应,故B正确;
C.脱脂棉燃烧需要达到其着火点,应由过氧化钠与二氧化碳、水反应提供热量,说明CO2、H2O与Na2O2的反应是放热反应,故C正确;
D.钠与氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠潮解,氢氧化钠溶液吸收二氧化碳生成碳酸钠晶体,碳酸钠晶体风化得到碳酸钠,故D正确,
故选:A.
点评 本题考查钠单质及其化合物性质,难度不大,注意钠在空气中的变化过程.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 25℃时,1L pH=13的Ba(OH)2溶液中含OH-数目为0.2NA | |
| C. | 1L 1mol•L-1的Na2CO3溶液中含有CO32-的数目为NA | |
| D. | 18g H2O中含1mol氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO${\;}_{3}^{2-}$ SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫离子的核外电子排布式:1s22s22p6 | |
| B. | 碳-14的原子组成符号:${\;}_{6}^{14}$C | |
| C. | 碳原子的外围电子轨道表示式: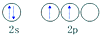 | |
| D. | Cl-的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一周期元素都是从碱金属开始,以稀有气体结束 | |
| B. | f区都是副族元素,s区和p区的都是主族元素 | |
| C. | 铝的第一电离能大于钾的第一电离能 | |
| D. | 同周期元素从左到右电负性逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2═Ca2++2Cl- | B. | NaHSO4═Na++H++SO42- | ||
| C. | HNO3═H++NO3- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标况下1 L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA/22.4 | |
| C. | 1 mol甲基含7 NA个电子 | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com