
 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示:
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol/L的硫酸溶液中,乙同学将电极放入6mol/L的NaOH溶液中,实验装置如图所示:分析 甲同学依据的化学反应原理是Mg+H2SO4=MgSO4+H2↑,乙同学依据的化学反应原理是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,由于Al显两性,与酸碱都能反应,
(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)若乙装置设计为氢气燃料电池,两极改为惰性电极,电解质溶液为碱,故则负极反应式为H2+2OH--2e-=2H2O;甲烷燃料电池以NaOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O.
解答 解:(1)甲中镁易失电子作负极、Al作正极,负极上镁发生氧化反应、正极上氢离子发生还原反应,负极反应为Mg-2e-=Mg2+,正极反应为2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)若乙装置设计为氢气燃料电池,两极改为惰性电极,电解质溶液为碱,故则负极反应式为H2+2OH--2e-=2H2O;甲烷燃料电池以NaOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是NaOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O,故答案为:H2+2OH--2e-=2H2O;CH4+10OH--8e-=CO32-+7H2O.
点评 本题考查了探究原电池原理,题目难度中等,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极,注意电解质溶液是否参与反应,为易错点.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:解答题
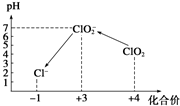
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
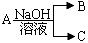 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).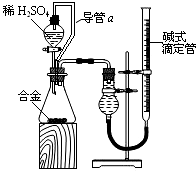
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3和 互为同分异构体 互为同分异构体 | |
| B. | 干冰和冰为同一种物质 | |
| C. | CH3CH3和CH3CH2CH3互为同系物 | |
| D. | 12C和14C互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 有关信息 |
| X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
| Y | M层上有3个电子 |
| Z | 短周期元素中原子半径最大的主族元素 |
| W | 其单质是淡黄色固体 |
| Q | 最高正价与最低负价代数和为6 |
| A. | 简单离子的半径大小顺序为:W>Q>Z>Y | |
| B. | W单质在氧气中燃烧后的产物不能使品红溶液褪色 | |
| C. | X、W和氢三种元素形成的化合物中只有共价键 | |
| D. | Z与W元素只能形成原子个数比为2:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铜粉在0.05mol氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 常温常压下,22.4L氙气中含有NA个氙分子 | |
| C. | 一定量的浓H2SO4与0.1molMg恰好完全反应,生成SO2为0.1NA | |
| D. | 标准状况下,22.4L由SO2和O3组成的混合气体中含有3NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
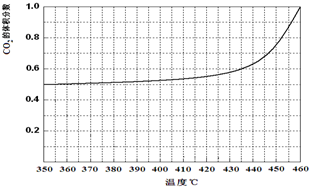
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验要求 | 化学试剂 | 供选择的化学试剂 |
| 检验味精中是否含有食盐 | A.新制氢氧化铜悬浊液 B.硝酸银溶液和稀硝酸 C.碘水 D.碳酸钠粉末 | |
| 检验地瓜粉中是否含有淀粉 | ||
| 检验食醋中是否含有乙酸 | ||
| 区别蔗糖和葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com