
 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 表一 | ||
| T/℃ | 400 | 500 |
| K | 32 | 44 |
| 表二 | |||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量浓度(mol?L-1) | 0.54 | 0.68 | 0.68 |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
| 0.68×0.68 |
| 0.542 |


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
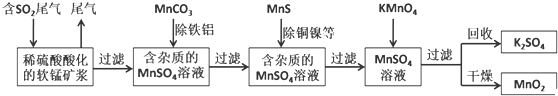
| ①443-573K |
| 熔烧 |
| ②进一步加热 |
| 到773-873K |
| 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
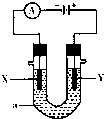 如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个电解池,装有电解质溶液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(盐酸)<n(稀硝酸)<n(烧碱) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(稀硝酸)<n(烧碱)<n(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |

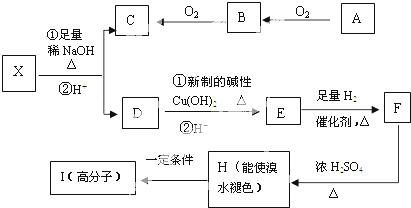
| KMnO4(OH-)溶液 | 铁钉(钢钉) | |
| 实验1 | 短时间内无明显现象 | 短时间内无明显现象 |
| 实验2 | 短时间溶液由紫红色(MnO4-)变为深绿色(MnO42-) | 短时间铁钉表面产生红褐色物质 |
| 请用化学用语解释实验2的现象 | | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com