
【题目】能正确表示四种基本反应类型与氧化还原反应关系的示意图是( )
A.
B.
C.
D.
【答案】D
【解析】解:A、复分解反应一定不属于氧化还原反应,则不会出现交叉,置换反应一定属于氧化还原反应,则应为包含,部分的化合与分解反应属于氧化还原反应,则不能是包含,应为交叉关系,故A错误;
B、复分解反应一定不属于氧化还原反应,则不会出现交叉,故B错误;
C、有单质生成的分解反应属于氧化还原反应,则分解反应与氧化还原反应的关系为交叉,不是全包含,故C错误;
D、置换反应一定属于氧化还原反应,则是包含关系,复分解反应一定不属于氧化还原反应,则不是包含也不是交叉关系,有单质生成的分解反应属于氧化还原反应,有单质参加的化合反应属于氧化还原反应,则化合、分解反应与氧化还原反应都是交叉关系,故D正确;
故选D.


科目:高中化学 来源: 题型:
【题目】美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、中子数为175的超重元素,该元素原子核内的中子数与核外电子数之差是( )
A. 57 B. 47 C. 61 D. 293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某磷肥厂利用某磷矿石[Ca3 (PO4) 2]制取磷肥[Ca (H2PO4 )2] 并综合利用副产物生产水泥的工艺流程如图:

(1)将磷矿石制成磷肥的目的是________,有关的化学方程式为__________.
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是____________.
(3)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,此时测得SO2的物质的量为1mol.则平衡常数K为______________
(4)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,用m(H2O)=kn(SO3)分别表示SO3转化成上述两种硫酸时,用水的质量与SO3物质的量的关系式分别是
m1(H2O)=____________ n1(SO3)
m2(H2O)=_________ n2(SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: 
(1)分类标准代号A表示(可多项)
a.两物质都是非电解质b.两物质都易溶于水
c.两物质都是含碳化合物d.两物质都是氧化物
(2)上述五种物质中的某一物质的饱和溶液中通入足量CO2 , 溶液中会有晶体析出.该反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室中,下列除杂的方法正确的是( )
A. 溴苯中混有溴,加入KI溶液,用汽油萃取
B. 乙烷中混有乙烯,通入H2在一定条件下反应,使乙烯转化为乙烷
C. 乙烷中混有乙炔,通入酸性高锰酸钾溶液洗气除去
D. 硝基苯中混有浓硫酸和浓硝酸,将其倒入NaOH溶液中,静置,然后分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由四原子分子构成,它的摩尔质量为M gmol﹣1 , 则:
(1)该气体的物质的量为mol.
(2)该气体中所含的原子总数为个.
(3)该气体在标准状况下的体积为L.
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
(5)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4 、浓硫酸、双氧水是常见的氧化剂。某小组同学用下图装置做浓硫酸与木炭反应的实验,以及检验生成的CO2和SO2。据此回答下列问题:
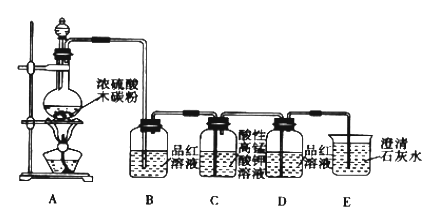
(1)木炭与浓H2SO4在加热条件下反应的化学方程式为:__________________________;
(2)装置B观察到的现象是品红溶液褪色,可确定该气体中含有_________________;说明该气体具有___________性;
(3)装置C中紫红色褪去,利用了SO2的还原性,MnO4-被还原为Mn2+,反应的离子方程式为________________________;还原剂与氧化剂的物质的量之比为_________;
(4)装置E观察到的现象是_______________________,该装置中发生的离子方程式是____________________________。
(5)若将装置A中生成的气体通入BaCl2溶液中是否产生沉淀?________(填“是”或“否”),如果通入Ba(NO3)2溶液中产生沉淀的化学式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com