
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A、等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) |
| B、a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b |
| C、NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| D、某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照 |
| B、将溶液倒在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| C、用干燥、洁净玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| D、在试管内放入少量溶液并煮沸,把pH试纸放在管口观察其颜色并与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
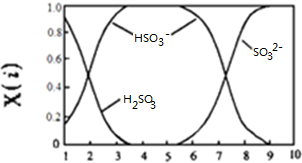
| A、pH=6时,C(H+)=C(SO32-)+C(OH-) |
| B、pH=2时,溶液中存在:C(Na+)>C(HSO3-)>C(H2SO3)>C(SO32-) |
| C、向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中会出现浑浊且pH值降为2,其离子方程式可表示为:Ca2++SO32-═CaSO3 |
| D、由图可知亚硫酸氢钠溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)25℃时,0.1mol?L-1的HA溶液中
(1)25℃时,0.1mol?L-1的HA溶液中| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| A- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
| ||
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
| ||
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向蔗糖中加入浓硫酸发生一系列反应,浓硫酸主要体现吸水性和酸性 |
| B、“半成品碳”是碳元素的一种新单质,与C60都是碳元素的同素异形体 |
| C、蔗糖的水解产物之一在碱性条件下加热,可与银氨溶液反应 |
| D、焦糖烯是一种新型的烯烃,其能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、I-、ClO-、Na+ |
| B、Ag+、NO3-、Cl-、K+ |
| C、K+、Na+、Ca2+、CO32- |
| D、Cu2+、Fe2+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com