
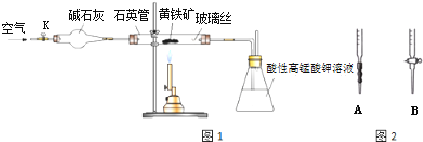
分析 (1)向锥形瓶中加水浸没导气管末端,关闭K,溶解微热石英管,根据锥形瓶中是否有气泡冒出,及冷却后导管内是否形成一端稳定的气柱判断该装置的稳定性;
(2)空气中含有氧气,空气还能够将生成的二氧化硫驱赶到锥形瓶中;
(3)若鼓入的空气速率过快,导致二氧化硫没有完全被酸性高锰酸钾溶液吸收;
(4)A为碱式滴定管,B为酸式滴定管,草酸为酸性溶液,应该使用酸式滴定管;滴定结束前溶液为紫红色,滴定结束后变为无色,据此判断滴定终点;
(5)根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O及草酸的量计算出25mL溶液中剩余的高锰酸钾的物质的量,再计算出100ml溶液中剩余的高锰酸钾的物质的量,从而得出二氧化硫消耗的高锰酸钾的物质的量,再根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4计算出二氧化硫的物质的量,根据S原子守恒计算出样品中S的质量及质量分数.
解答 解:(1)连接好装置,检查装置气密性的方法为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱,
故答案为:向锥形瓶中加水浸没导气管末端,关闭K,微热石英管,观察到锥形瓶中有气泡冒出,冷却后导管内形成一端稳定的气柱;
(2)煅烧黄铁矿时需要氧气,则通入空气的目的是提供反应需要的氧气,另外通入空气后还可以将生成的二氧化硫完全赶入锥形瓶中,从而减小实验误差,
故答案为:提供反应所需O2,将生成的SO2全部赶入锥形瓶中;
(3)若实验过程中鼓入空气的速率过快,会导致部分二氧化硫没有被酸性高锰酸钾溶液吸收,则测得的硫元素的质量分数会偏低,
故答案为:偏低;
(4)草酸显示酸性,需要选用酸式滴定管盛放,即应该选用B盛放草酸溶液;滴定结束时溶液由浅紫色变为无色,则滴定终点的现象为:由浅紫色突变为无色且半分钟内不再变色,
故答案为:B;由浅紫色突变为无色且半分钟内不再变色;
(5)0.23mol/L标准H2C2O4溶液21.73mL中含有草酸的物质的量为:0.23mol/L×0.02173L=0.0050mol,根据反应5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O可知,0.0050mol草酸完全反应消耗高锰酸根离子的物质的量为:0.0050mol×$\frac{2}{5}$=0.002mol,
原100mL滴定后的高锰酸钾溶液中含有高锰酸钾的物质的量为:0.002mol×$\frac{100ml}{25ml}$=0.008mol,
100mL 0.2mol/L酸性KMnO4溶液中含有高锰酸钾的物质的量为:0.2mol/L×0.1L=0.02mol,则二氧化硫消耗的高锰酸钾的物质的量为:0.02mol-0.008mol=0.012mol,根据反应2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4可知,二氧化硫的物质的量为:0.012mol×$\frac{5}{2}$=0.03mol,原样品中含有S的质量为:32g/mol×0.03mol=0.96g,含有硫元素的质量分数为:$\frac{0.96g}{2g}$×100%=48%,
故答案为:48%.
点评 本题考查物质组成及含量的测定方法,题目难度较大,明确测定原理为解答关键,注意掌握化学实验基本操作方法,明确中和滴定原理及操作方法,试题侧重考查学生灵活应用基础知识的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
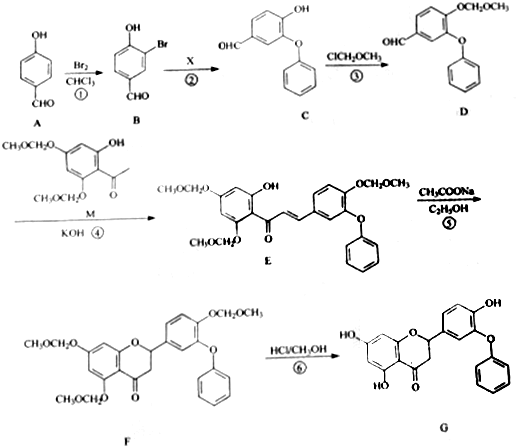
 .
.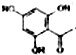 制得,写出同时满足下列条件的
制得,写出同时满足下列条件的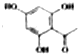 的一种同分异构体的结构简式
的一种同分异构体的结构简式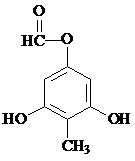 或
或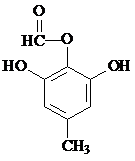 .
. 为原料,合成
为原料,合成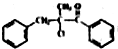 ,写出合成流程图
,写出合成流程图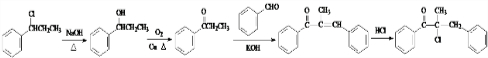 (无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
(无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
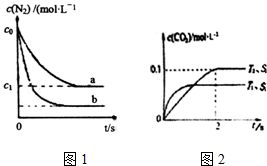 汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.
汽车尾气是城市主要空气污染物,研究控制汽车尾气排放是保护环境的首要任务.| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(×10-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.60 | 1.00 | 1.00 |
| c(CO)/(×10-3mol•L-1) | 3.60 | 3.05 | 2.85 | 2.76 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: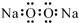 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 乙烯的结构简式为CH2CH2 | D. | 硫原子的结构示意图: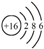 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不可能生成90g 乙酸乙酯 | B. | 生成的乙酸乙酯中含有18O | ||
| C. | 可能生成61.6g 乙酸乙酯 | D. | 生成的水分子中一定含有18O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4 KNO3 Na2CO3 NH4Cl | B. | H2SO4 BaCl2 Na2SO4 NaOH | ||
| C. | MgCl2 AgNO3 KNO3 HCl | D. | NH4HCO3 NaOH NaCl HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com