
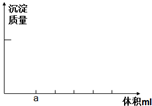
 ��1.71�����������100ml��Һ��Ϊ������ˮ�⣬�����ù����м����������ᣮ����������Һ����μ���0.5mol/L������������Һ��ֱ����������ͼ���¼�μӹ����в��������Ĺ��̣�
��1.71�����������100ml��Һ��Ϊ������ˮ�⣬�����ù����м����������ᣮ����������Һ����μ���0.5mol/L������������Һ��ֱ����������ͼ���¼�μӹ����в��������Ĺ��̣� 
���� ��1�������Һ������Ϊ�����������ᣬ����Һ�еμ�NaOH��NaOH�Ⱥ�ϡ���ᷴӦ������0-a֮�䷢���ķ�ӦΪ����кͷ�Ӧ��a�������ǡ�÷�Ӧ�㣬�����μ�NaOHʱ���������ƺ������ӷ�Ӧ�����������������������������ȫת��Ϊ���������μ�NaOH��NaOH�ٺ�����������Ӧ����ƫ��������ӣ�
��2�����a=20����Ӧ�������պ���ȫ��ʧʱ����Һ������Ϊƫ�����ƺ������ƣ������������غ㡢����������غ�����������ʵ���Ũ�ȣ�
��� �⣺��1�������Һ������Ϊ�����������ᣬ����Һ�еμ�NaOH��NaOH�Ⱥ�ϡ���ᷴӦ������0-a֮�䷢���ķ�ӦΪ����кͷ�Ӧ��a�������ǡ�÷�Ӧ�㣬�����μ�NaOHʱ���������ƺ������ӷ�Ӧ�����������������������������ȫת��Ϊ���������μ�NaOH��NaOH�ٺ�����������Ӧ����ƫ��������ӣ����ӷ���ʽΪ3OH-+Al3+=Al��OH��3����Al��OH��3+OH-=AlO2-+2H2O�����ݷ���ʽ֪�����ɳ����������ʧ��ҪNaOH��Һ���֮��Ϊ3��1������Alԭ���غ������n[Al��OH��3]=2 n[Al2��SO4��3]=2��$\frac{1.71g}{342g/mol}$=0.005mol��2=0.01mol��m[Al��OH��3]=78g/mol��0.01mol=0.78g��
����3OH-+Al3+=Al��OH��3����n��NaOH��=6n[Al2��SO4��3]=0.005mol��6=0.03mol������Al��OH��3+OH-=AlO2-+2H2O�ó����ܽ�����n��NaOH��=2n[Al2��SO4��3]=0.005mol��2=0.01mol����������������������ֱ�Ϊ��$\frac{0.03mol}{0.5mol/L}$=60mL��$\frac{0.01mol}{0.5mol/L}$=20mL��������ͼ��Ϊ ��
��
�ʴ�Ϊ��3OH-+Al3+=Al��OH��3����Al��OH��3+OH-=AlO2-+2H2O�� ��
��
��2�����a=20����Ӧ�������պ���ȫ��ʧʱ����Һ������Ϊƫ�����ƺ������ƣ����ݣ�1��֪�����ɳ������������������Ϊ60mL�������ܽ�����V��NaOH��Ϊ80mL�����Գ���ǡ���ܽ�ʱ�����Һ���Ϊ��100+20+60+20��mL=0.2L��
�����������غ��c��NaAlO2��=$\frac{0.005mol��2}{0.2L}$=0.05mol/L��
a������20mL�������ƣ�����Naԭ���غ��n��Na2SO4��=$\frac{1}{2}$n��NaOH��=$\frac{1}{2}$��0.5mol/L��0.02L=0.005mol��
��������������غ㣬����ǡ���ܽ�ʱ��Һ��c��Na2SO4��=$\frac{0.005+0.005��3}{0.2L}$=0.10mol/L��
�ʴ�Ϊ��c��Na2SO4��=0.10mol/L��c��NaAlO2��=0.05 mol/L��
���� ���⿼�����ӷ���ʽ�ļ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷͼ�и��������ǽⱾ��ؼ���ע�⣨2���������ư�����������������ɵ������ƣ�Ϊ�״��㣮


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ơ��ƿ���д��������ݳ� | |
| B�� | ���ڷ�ӦI2��g��+H2��g��?2HI��g���ﵽƽ�������ѹǿ������ɫ���� | |
| C�� | ��ɫCoCl2��Һ��������Һ��ɫ��Ϊ��ɫ���ñ�ˮ��ȴ��Һ��ɫ��Ϊ�ۺ�ɫ | |
| D�� | ��ҵ�ϳɰ���N2��g��+3H2��g��?2NH3��g����H=-92.4 kJ/mol��ѡ���ѹ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ͭ˿������������Һ�� | B�� | ������ԭ����ͭ | ||
| C�� | ��Ƭ��������ͭ��Һ�� | D�� | һ����̼��ȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ȷֽⷨ | B�� | �Ȼ�ԭ�� | C�� | ��ⷨ | D�� | �û��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH4CO3 $\frac{\underline{\;\;��\;\;}}{\;}$NH3��+H2O��+CO2�� | B�� | 2Na2O2+2 H2O�T4NaOH+O2�� | ||
| C�� | H2O+Cl2?HCl+HClO | D�� | NH3+SO2+H2O�TNH4HSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ƽ�Ĺ��չ�����Ӧ���������ܽ�ȵIJ��� | |
| B�� | ����պŨ����IJ��������鰱���Ƿ����ռ��� | |
| C�� | �������������Ԫ�أ�����Ҫ��Ը����ߵ����ʳ�� | |
| D�� | �ڻ�ҩ����ǡ���ʯ��ľ̿�������ʰ�һ����������Ƴ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com