
下列各粒子:①H3O+、NH4+、Na+;②OH-、NH2-、F-;③O2-、Na+、Mg2+;④CH4、NH3、H2O具有相同质子数和电子数的一组是
A. ①②③ B. ①②④ C. ②③④ D. ①③④
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:填空题
NH3是一种重要的化工原料,也是造成水体富营养化及氮氧化物污染的重要因素之一。
(1)N2和H2以物质的量之比为1∶3在不同温度和压强下发生反应:N2+3H2 2NH3,测得平衡体系中NH3的物质的量分数如图1。
2NH3,测得平衡体系中NH3的物质的量分数如图1。

①为提高原料气的转化率,工业上采取的合理措施有 (填字母)。
a. 采用常温条件
b. 使用适当的催化剂
c. 将原料气加压
d. 将氨液化并不断移出
②图1中所示的平衡体系中NH3的物质的量分数为0.549和0.488时,该反应的平衡常数分别为K1、K2,则K1 K2。(填“>”“<”或“=”)
(2)氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,涉及的相关反应如下:
反应①:NH3+HClO===NH2Cl+H2O
反应②:NH2Cl+HClO===NHCl2+H2O
反应③:2NHCl2+H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变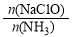 (即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
(即NaClO溶液的投入量),溶液中次氯酸钠对氨氮去除率及余氯量 (溶液中+1价氯元素的含量)的影响如图2所示。
①反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为 。
②a点之前氨氮去除率较低的原因为 。
(3)电解硝酸工业的尾气NO可制备NH4NO3,其工作原理如图3。
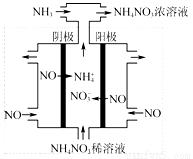
①电解过程(虚线内)发生反应的离子方程式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆一中高一下期末化学试卷(解析版) 题型:选择题
不能用化学键的牢固程度解释的是
A.金属Na熔沸点高于金属K
B.非金属性N>P,但是单质活泼性:氮气<白磷
C.相同条件下,NH3在水中的溶解度大于PH3
D.SiC晶体的熔点比晶体硅的高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.稀醋酸中加入少量醋酸钠固体减小醋酸的电离程度
B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液pH约为12
C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
【答案】C
【解析】
试题分析:A.醋酸在溶液中存在电离平衡:CH3COOH CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
CH3COO-+H+,当想稀醋酸中加入少量醋酸钠固体时,溶液中c(CH3COO-)增大,醋酸的电离平衡逆向移动,从而减小了醋酸的电离程度,正确;B.0.02 mol·L-1HCl溶液与0.02 mol·L-1Ba(OH)2溶液等体积混合后,溶液中c(OH-)=(0.02 mol·L-1×2-0.02 mol·L-1)÷2=0.01mol/L,由于在室温下水的离子积常数是10-14,所以c(H+)=10-12mol/L,故溶液pH约为12,正确;C.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,第一种溶液中氢离子的浓度是第二种溶液中氢离子浓度的10倍。由于溶液的浓度越大,其电离程度就越小,所以则c1>10c2,错误;D.pH=11的NaOH溶液的氢氧根离子的浓度与pH=3的醋酸溶液中氢离子的浓度相等。由于醋酸是弱酸,主要以电解质分子存在,在溶液中存在电离平衡,党二者等体积混合后,由于醋酸过量,溶液显酸性,滴入石蕊溶液时,溶液呈红色,正确。
考点:考查电解质溶液的有关知识。
【题型】选择题
【适用】较难
【标题】【百强校】2015-2016学年陕西西安高新一中高一下期末化学试卷(带解析)
【关键字标签】
【结束】
一定量的混合气体,在密闭容器中发生如下反应:xA(g)+yB(s) zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,当恒温下将密闭容器的容积扩大到两倍再达到平衡后,测得A的浓度为0.3 mol·L-1,则下列叙述正确的是
A.C的体积分数降低
B.x+y=z
C.平衡向正反应方向移动
D.x+y<z
查看答案和解析>>
科目:高中化学 来源:2015-2016学年陕西西安高新一中高一下期末化学试卷(解析版) 题型:选择题
已知:①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H1
②2CO(g)+O2(g)=2CO2(g) △H2
③2H2(g)+O2(g)=2H2O(l) △H3
④2H2(g)+O2(g)=2H2O(g) △H4
⑤CO(g)+2H2(g)=CH3OH(g) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H2<0
B.△H3>△H4
C.△H1=△H2+2△H3-△H5
D.2△H5+△H1<0
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:填空题
(1)据报道,北京奥运会“祥云”火炬燃料为丙烷,悉尼奥运会火炬燃料为丁烷和丙烷混合气。标准状况下,1.0mol丙烷和丁烷的混合气和足量氧气混合完全燃烧后,恢复至原状态,混合气体的体积减小了70.0L,混合气体中丙烷和丁烷的体积比为______
(2)用一个甲基,一个乙基、一个—C3H7分别取代苯环上的氢原子,所得的三取代物有 种。
(3) 组成的混合物中碳的质量分数为 。
组成的混合物中碳的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高一下期末化学试卷(解析版) 题型:选择题
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体,下列说法中错误的是
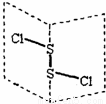
A.S2Cl2的结构式为 Cl—S—S—Cl
B. S2Cl2与水反应时只有S—Cl断裂
C.S2Br2含有极性键和非极性键
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:填空题
天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料。
(1)可燃冰(mCH4·nH2O)属于 晶体。
(2)已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=
(3)用甲烷?空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:

①a电极名称为 。
②c电极的电极反应式为 。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是 L(空气中O2体积分数约为20%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com