
将1molCO与1molH2O(气)混合,在一定条件下反应:CO+H2O==CO2(气)+H2(气),达到平衡时,CO的转化率为21.75%。则平衡混合气体的平均密度是相同条件下H2密度的( )倍。
A、5.75 B、11.5 C、23 D、46
科目:高中化学 来源: 题型:阅读理解
| 1 |
| 50 |
| 1 |
| 50 |
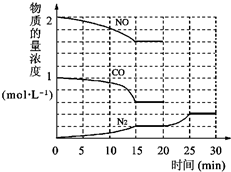 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素.
环境问题备受世界关注.化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)、硫化物等气体己成为大气污染的主要因素. O2+Hb?CO
O2+Hb?CO N2(g)+2CO2(g)△H=-113kJ?mol-1
N2(g)+2CO2(g)△H=-113kJ?mol-1| 0.4 |
| 15 |
| 0.4 |
| 15 |
 H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)已知反应:CO(g) + H2O(g)![]() CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1molCO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号)
A. 22.2% B.27.55% C.33.3% D.36.8%
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比较,则下列说法中正确的是 (填序号)
①生成物的产量一定增加 ②反应物的浓度一定降低
③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题



| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com