
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
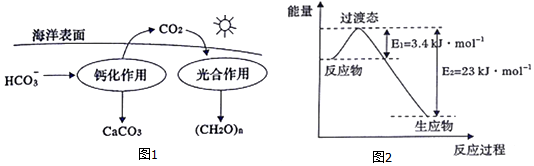
分析 (1)①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子,分别为CO32-和HCO3-;
②根据图1的转化方式分析,钙化作用过程中,HCO3-通过钙化作用生成CaCO3,可知Ca2+与HCO3-在此反应中生成CaCO3,据此写出反应的离子方程式;
(2)电池反应为:4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C,放电池,为原电池反应,原电池中正极物质得电子,发生还原反应,据此判断,充电时,为电解池反应,阳极为物质失去电子,发生氧化反应,结合总反应式分析,据此写出阳极的电极反应方程式;
(3)CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气,反应方程式为:CO2(g)+3H2(g)$?_{催化剂}^{230℃}$CH3OH(g)+H2O(g),反应为气体数减少的反应,增大压强有利于反应正向进行,根据能量变化图,反应物能量高于生成物,则反应为放热反应,降低温度有利于反应正向进行,据此逐项分析判断化学反应达到平衡的标志;
(4)①反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应的化学平衡常数为K=$\frac{c({H}_{2})c(C{O}_{2})}{c({H}_{2}O)c(CO)}$,根据实验2的数据,结合化学反应方程式计算平衡时各组分的物质的量浓度,代入平衡常数的表达式计算;
②实验3中,若平衡时,CO的转化率大于水蒸气,CO和水蒸气是按1:1反应进行的,增大其中一种反应物的量可以增大另一反应物的平衡转化率,据此分析;
③温度不变,平衡常数不变,根据此时的反应商J和平衡常数K的关系,判断化学反应进行的方向,分析化学反应正逆速率的大小关系;
(5)甲醇不完全燃烧生成一氧化碳和液态水的化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l),该反应可由已知焓变的热化学方程式推导,根据盖斯定律计算该反应的焓变.
解答 解:(1)①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子,分别为CO32-和HCO3-,
故答案为:HCO3-;CO32-;
②根据图1的转化方式分析,钙化作用过程中,HCO3-通过钙化作用生成CaCO3,可知Ca2+与HCO3-在此反应中生成CaCO3,则反应的离子方程式为:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O,
故答案为:Ca2++2HCO3-═CaCO3↓+CO2↑+H2O;
(2)电池反应为:4Na+3CO2 $?_{放电}^{放电}$2Na2CO3+C,放电池,为原电池反应,原电池中正极物质得电子,发生还原反应,则放电时,在正极得电子的物质为CO2,
充电时,为电解池反应,阳极为物质失去电子,发生氧化反应,根据总反应方程式,应为C失去电子,变成CO2,则充电时,阳极的反应式为:C-4e-+2CO32-═3CO2,
故答案为:CO2;C-4e-+2CO32-═3CO2;
(3)CO2和H2在230℃并有催化剂条件下转化生成甲醇蒸汽和水蒸气,反应方程式为:CO2(g)+3H2(g)$?_{催化剂}^{230℃}$CH3OH(g)+H2O(g),反应为气体数减少的反应,增大压强有利于反应正向进行,根据能量变化图,反应物能量高于生成物,则反应为放热反应,降低温度有利于反应正向进行,
A.反应在恒压装置中反应,整个反应过程体系压强一直不变,不能根据压强判断化学反应是否达到平衡,故A不选;
B.随着反应的进行,各组分的体积分数会改变,当H2的体积分数不变时,可以判断化学反应是否达到平衡,故B选;
C.平衡时,不一定具有关系c(H2)=3c(CH3OH),需根据具体的反应的初始的量来判断,不可以判断化学反应是否达到平衡,故C不选;
D.容器中混合气体的密度为$ρ=\frac{m}{V}$,反应前后,根据质量守恒,m不变,反应为恒压装置,随着反应的进行,气体总体积会发生改变,当气体总体积不变,也就是密度不变时,可以判断化学反应是否达到平衡,故D选;
E.2个C=O断裂的同时有6个H-H断裂表明反应物CO2和H2均在参加反应,反应向正反应方向进行,不一定是化学反应已经达到平衡,不可以判断化学反应是否达到平衡,故E不选,
故选BD;
(4))①反应为:CO(g)+H2O(g)?CO2(g)+H2(g),反应的化学平衡常数为K=$\frac{c({H}_{2})c(C{O}_{2})}{c({H}_{2}O)c(CO)}$,根据实验2的数据,则平衡时,c(CO)=$\frac{1.6mol}{2L}$=0.8mol/L,c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,c(H2O)=$\frac{1mol-0.4mol}{2L}$=0.3mol/L,c(CO2)=0.2mol/L,则反应的平衡常数为K=$\frac{0.2mol/L×0.2mol/L}{0.3mol/L×0.8mol/L}$=$\frac{1}{6}$,
故答案为:$\frac{1}{6}$;
②实验3中,若平衡时,CO的转化率大于水蒸气,CO和水蒸气是按1:1反应进行的,增大其中一种反应物的量可以增大另一反应物的平衡转化率,所以可判断是增大了水蒸气的量,则$\frac{a}{b}$<1,
故答案为:<;
③温度不变,平衡常数不变,根据实验2,900℃时,体系中平衡时各组分的浓度为:c(CO)=$\frac{1.6mol}{2L}$═0.8mol/L,c(H2O)=$\frac{2mol-1.6mol}{2L}$=0.2mol/L,c(H2)=$\frac{0.4mol}{2L}$=0.2mol/L,c(CO2)=0.2mol/L,则反应的化学平衡常数为K=$\frac{c({H}_{2})c(C{O}_{2})}{c({H}_{2}O)c(CO)}$=$\frac{1}{4}$,在此容器中加入CO、H2O、CO2、H2均为1mol,则起始浓度为:c(CO)=c(H2O)=c(CO2)=c(H2)=0.5mol/L,反应商为J=$\frac{0.5mol/L×0.5mol/L}{0.5mol/L×0.5mol/L}$=1>K,则反应向逆反应方向移动,v(正)<v(逆),
故答案为:<;
(5)已知:①2CH3OH(I)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol,
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
③H2O(g)=H2O(l)△H3=-44.0kJ/mol,
甲醇不完全燃烧生成一氧化碳和液态水的化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l),该反应可由$\frac{①-②}{2}+③×2$得到,根据盖斯定律,该反应的焓变为△H=$\frac{△{H}_{1}-△{H}_{2}}{2}+2△{H}_{3}$=-442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ/mol.
点评 本题主要化学原理知识,包含离子方程式的书写和配平,电极反应式的书写,原电池和电解池的原理,化学平衡的移动,化学平衡常数的计算和简单应用,热化学方程式的书写和盖斯定律的应用,涉及的知识点较多,考查综合能力,题目难度中等.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题

| A. | M室发生的电极反应式为:2H2O-4e-=O2↑+4H+ | |
| B. | N室中:a%<b% | |
| C. | b膜为阴离子交换膜 | |
| D. | 理论上每生成1mol产品,阴极室可生成5.6L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20gD2O含电子数目为10NA | |
| B. | 标准状态下84gC3H6中含碳碳双键的数目为2NA | |
| C. | 1 L 0.1 mol/L NH4NO3溶液中含铵根离子数目小于0.1NA | |
| D. | 标准状态下44.8LCl2与足量水反应转移的电子数目一定小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ①② | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
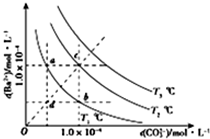
| A. | T2温度下将d点的溶液蒸发浓缩可变为c点 | |
| B. | a点的Ksp小于B点的Ksp | |
| C. | b点溶液中加入BaCl2固体可变为c点 | |
| D. | a点溶液蒸发浓缩恢复到原温度可变为b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
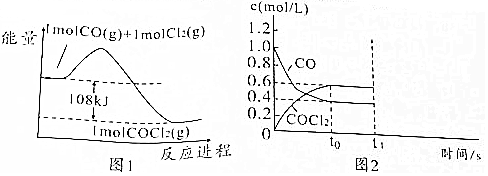
 ;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;
;光气遇水后生成两种气体,其中一种气体极易溶于水,反应的化学方程式为COCl2+H2O═2HCl+CO2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯是纯净物,聚乙烯是混合物,都能使酸性KMnO4溶液褪色 | |
| B. | 取等质量的乙烯和和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| C. | 常温下乙烯为气态,聚乙烯为固态 | |
| D. | 乙烯可以发生加成聚合反应生成聚乙烯,聚乙烯的单体是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 →
→
| A. | 香茅醛能使Br2的CCl4溶液褪色 | |
| B. | 青蒿素分子中含有酯基和醚键等官能团 | |
| C. | 青蒿素在一定条件下可发生水解反应 | |
| D. | 二者均可与氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某化学兴趣小组设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )
某化学兴趣小组设置了如图所示的实验装置,既可用于制取气体,又可用于验证物质的性质,下列说法不正确的是( )| A. | 利用I、II装置制取气体(K2关闭、K1打开),可以在II中收集H2等气体,但不能收集HCl气体 | |
| B. | 若装置II中装满水后,可以收集O2、NO等气体,但不能收集NO2、CO2等气体 | |
| C. | 利用I、Ⅲ装置(K1关闭、K2打开,A中装硝酸)可以比较N、C、Si元素非金属性强弱 | |
| D. | 若在Ⅲ装置的小试管C中加入一定量CCl4和AgNO3溶液(导管伸入CCl4层),则利用I、Ⅲ装置(K1关闭、K2打开)可验证苯与液溴发生的是取代反应,不是加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com