
【题目】某微粒的结构示意图为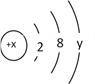 ,试回答:
,试回答:
(1)x表示____________,y表示____________。
(2)当x-y > 10时,该微粒是________(选填“阳离子”或“阴离子”或“原子”)
(3)当![]() 时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
时,该微粒带有2个单位的负电荷,则该微粒的符号为_________,该微粒的结构示意图为____________
(4)当y=2的中性原子M跟y=7的中性原子N化合时,形成化合物的化学式为__
【答案】 质子 最外层电子 阳离子 S2-  MgCl2
MgCl2
【解析】(1)原子结构示意图中,圆圈中数字表示质子数;最外层电子数决定其化学性质;
(2)判断质子数与核外电子数是否相等,据此解答;(3)y=8时,该微粒带2个单位负电荷,则x=2+8+8-2=16,为S2-离子;(4)当y=2的中性原子M的核外电子数为2+8+2=12,则M为Mg,y=7的中性原子N的核外电子数为2+8+7=17,N为Cl元素,据此解答。
(1)原子结构示意图中,圆圈中数字x代表质子数或核电荷数;y为最外层电子数,因此,本题正确答案是:质子数或核电荷数;最外层电子数;
(2)当x-y > 10,说明微粒质子数>核外电子数,该微粒带正电荷,为阳离子,因此,本题正确答案是:阳离子;
(3) y=8时,该微粒带2个单位负电荷,则x=2+8+8-2=16,为S2-离子;其结构示意图为: ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ;
; ;
;
(4) 当y=2的中性原子M的核外电子数为2+8+2=12,则M为Mg,y=7的中性原子N的核外电子数为2+8+7=17,N为Cl元素,二者形成化合物的化学式为: MgCl2,因此,本题正确答案是: MgCl2。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】铈是地壳中丰度最高的稀土元素,可用作催化剂、合金添加剂,也可用于医药、制革、玻璃、纺织等工业。氟碳铈矿的主要化学成分为CeFCO3,它是提取铈的重要矿物原料。氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下图所示。
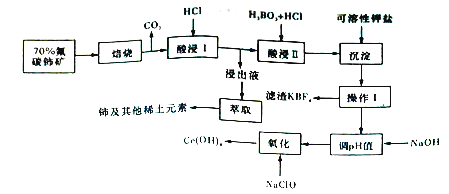
已知:焙烧后烧渣中含+4价的铈及十3价的其他稀土氟化物和氧化物。
请回答下列问题:
(1)CeFCO3中Ce元素的化合价为______。
(2)“焙烧”前将矿石粉碎成细颗粒的目的是___________________________________________。
(3)“酸浸I”步骤中CeO2转化为Ce3+,且产生黄绿色气体,该过程的离子方程式为___________________。
(4)“酸浸1”步骤中CeF4转化为难溶物Ce(BF4)3,加入可溶性钾盐的目的是__________________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液pH可获得Ce(OH)3沉淀,利用pH试纸测定溶液pH值的实验操作是__________________________________。当溶液中离子浓度小于1×10-6mol/L时视为沉淀完全,常温下,加入NaOH调节溶液的pH应大于____[已知Ce(OH)3的Ksp=8.0×10-21,1g2=0.3]。
(6)写出“氧化”步骤的化学方程式:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①16O和18O ②红磷和白磷 ③CH3CH3和CH3CH2CH2CH3 ④CH3CH2CH2CH3 和CH3CH (CH3)CH3 ⑤O2和O3 ⑥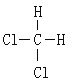 和
和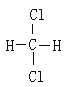
(1)属于同素异形体的是______________________ 。
(2)互为同位素的是___________________。
(3)互为同分异构体的是______________________。
(4)属于同系物的是___________________________。
(5)属于同种物质的是_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于1.0mol·L-1的NaCl溶液说法正确的是 ( )
A. 溶液中含1mol NaCl B. 1L溶液中含58.5克NaCl
C. 1mol NaCl溶于1L水中 D. 58.5克NaCl溶于941.5克水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原子是由________和________构成的,原子核是由_______和_______构成的,(_______)的原子核中只有质子),原子的质量主要取决于_________的质量。
(2)写出下列物质的电子式Mg__________ Cl-__________NaCl __________ HCl _____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素是指每种质量不到体重的万分之一,质量总和不到人体质量的千分之一的近二十种元素,这些元素对人体正常代谢和健康起着重要作用.下列元素不是微量元素的是( )
A.I
B.H
C.Zn
D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇燃料电池被认为是21世纪电动汽车候选动力源
(1)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H1=+49.0kJmol﹣1
②CH3OH(g)+ ![]() O2(g)═CO2(g)+2H2(g)△H2
O2(g)═CO2(g)+2H2(g)△H2
已知H2(g)+ ![]() O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
O2(g)═H2O(g)△H=﹣241.8kJmol﹣1 , 则反应②的△H2= .
(2)工业上一般可采用如图1所示反应来合成甲醇:CO(g)+2H2(g)CH3OH(g),现实验室模拟该反应并进行分析,图1是该反应在不同温度下CO的转化率随时间变化的曲线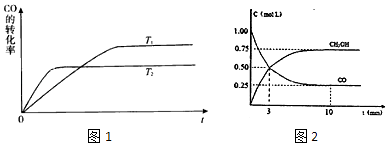
①该反应的焓变△H0(填“>”“<”或“=”).
②T1和T2温度下的平衡常数大小关系是K1K2(填“>”“<”或“=”)
③现进行如下实验,在体积为1L的密闭容器中,充入1molCO和3molH2 , 测得CO 和CH3OH(g)的浓度随时间变化如图2所示.从反应开始到平衡,CO的平均反应速率v(CO)= , 该反应的平衡常数为K=![]()
④恒容条件下,达到平衡后,下列措施中能使 ![]() 增大的有
增大的有
A.升高温度 B.充入He(g)
C.再充入1molCO 和3molH2 D.使用催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是 ()
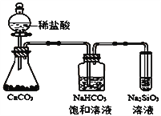
A. 气态氢化物的稳定性:H2O>NH3
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 如图所示实验可证明元素的非金属性:Cl>C>Si
D. 人工合成的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
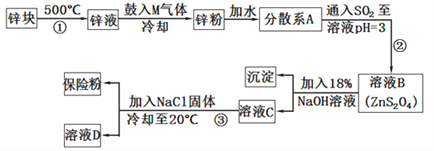
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项_____________________(任写一项)。
(2)向液锌中鼓入M气体,使液态锌雾化,目的是___________________;鼓入的气体M为空气的一种主要成分,则M的电子式为________________;
(3)流程②的化学方程式为________________________________________________。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中过滤用到的玻璃仪器除烧杯、玻璃棒外还有________;洗涤所用试剂是_______;实验时加入NaCl固体的作用是____________________________。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com